معرفی بیوشیمی آنزیم ها و نحوه عملکرد آن ها
آنزیم ها در لحظه هزاران واکنش را در بدن انسان و سایر موجودات زنده انجام می دهند. آنزیمها علاوه بر نقش های بیوشیمیایی در صنعت نیز کارایی دارند. آنزیم ها درواقع کاتالیزگر های زیستی بوده و موجب سرعت واکنش های بیوشیمیایی می شوند، بدون اینکه خود در واکنش مصرف گردند. مطالعه واکنش های بیوشیمی بسیار حائز اهمیت است. به بررسی واکنش های آنزیمی که در بدن رخ میدهد، بیوشیمی آنزیم می نامند. بنابراین شناخت بیوشیمی آنزیم ها مسئله ای مهم در پیشرفت علم و صنعت محسوب می شود. توجه شود که بیشتر آنزیم ها از پروتئین ساخته شده اند و در همه سلول ها نیز یافته می شوند.
با توجه به اهمیت واکنش های بیوشیمایی و نقش آنزیم ها در آن در ادامه این مطلب از جهان شیمی فیزیک به بررسی بیوشیمی آنزیم ها و نحوه عملکرد آنزیم ها در واکنش های بیوشیمیایی می پردازیم. با ما همراه باشید تا بیشتر اهمیت بیوشیمی آنزیم ها و ساختار آن ها آشنا شوید.
آنزیم چیست زیست دهم
آنزیمها کاتالیزور هایی زیستی هستند که با عملکرد خود موجب افزایش سرعت واکنشهای شیمیایی درون بدن جانداران (واکنش های بیوشیمی) می گردند. از مزایا بیوشیمی آنیزیم ها این است که بدون اینکه در واکنش مصرف شوند، نقش خود را ایفا خواهند نمود. هر آنزیم برای انجام واکنش خود به سوبسترا خاصی نیاز دارد. سوبسترا واکنشدهندهای است که در واکنش آنزیمی وجود دارد. بنابراین در هر واکنش آنزیمی به یک آنزیم خاص نیاز است.
بیوشیمی ساختار آنزیم ها
بیشتر آنزیم ها از جنس پروتئین ساخته شده اند. البته باید توجه شود که برخی از آنزیم ها برای انجام واکنش های بیوشیمیایی به یک بخش غیرپروتئینی به نام کوفاکتور نیازمند هستند. آنزیمی که کوفاکتور آن در محیط حضور نداشته باشد، غیرفعال بوده و آپوآنزیم نامیده می شود. وقتی کوفاکتور به آنزیم متصل شود به آنزیم فعال یا هولوآنزیم تبدیل می گردد. کوفاکتور ها هم می توانند از جنس مولکول های آلی بوده و یا حتی از جنس یون های فلزی باشند. در برخی مواقع کوفاکتورها بسیار محکم به آنزیم ها متصل میشوند، به طوریکه بدون تخریب آنزیم نمی توان آن ها را جدا نمود.
ساختار آنزیم
در ادامه این مطلب به بررسی ساختار و بیوشیمی آنزیم ها می پردازیم. آنزیم های پروتئینی از اسیدهای آمینه ساخته شدهاند. بنابراین مانند پروتئینها دارای ساختار اول، دوم و سوم هستند.
ساختار اول آنزیم ها
اسیدهای آمینه توسط پیوند پپتیدی و به شکل زنجیری به هم متصل هستند. این اسید های آمینه ساختار اولیه آنزیم ها را تشکیل خواهند داد. این زنجیر، زنجیر پلیپپتید نامیده شده و نحوه اتصال آمینواسیدهای تشکیل دهنده آن توسط DNA کد گذاری گردیده است.
ساختار دوم
در هر آمینواسید در ساختار پلی پپتید، اتم هیدروژن گروه آمین (NH2) و اتم اکسیژن گروه کربوکسیل (COOH) میتوانند با پیوند هیدروژنی به یکدیگر متصل شوند. در اینصورت پلیپپتید روی خود پیچ خرده و ساختارهای α-هلیکس و β-شیت را ایجاد خواهد نمود.
ساختار سوم
پس از تشکیل ساختارهای دوم، زنجیر پلی پپتیدی بیشتر روی هم پیچ خورده و ساختار سوم را ایجاد می کند که شکلی سه بعدی دارد.
آیا همه آنزیم ها پروتئینی هستند
بررسی واکنشهای آنزیمی انجام شده توسط بدن را بیوشیمی آنزیم ها می نامند. با مطالعه بیوشیمی آنزیم ها می توان آنزیمهای موجود در خون یا سرم بدن را شناسایی کرده و مشکلات پیش آمده در سلامتی را حل نمود. بیشتر آنزیمها از جنس پروتئین هستند. البته استثنا نیز وجود داشته و آنزیم هایی از جنس RNA وجود داشته که به آن ها ریبوزوم گفته می شود. توجه شود که در هر سلول هزاران آنزیم وجود داشته که به واکنشهای سلولی سرعت می بخشند.
واحد آنزیم چیست
واحد جهانی آنزیم واحدی از فعالیت کاتالیزوری آنزیم هاست و واحد آنزیم با نماد U نشان داده می شود. این واحد در سال ۱۹۶۴ توسط اتحادیه جهانی بیوشیمی به تایید رسیده است. هر یک U با کاتالیز تبدیل یک میکرومول بستر برابر است و در شرایط ویژه و مشخص توسط آنزیم صورت می پذیرد. البته باید توجه شود که عواملی همچون دمای مناسب، غلظت بستر و میزان pH کنترل شده در این تبدیل حائز اهمیت هستند.
اهمیت بیوشیمی آنزیم ها
یکی از منابع بسیار ارزشمند بدن ما انرژی سلولی است. همانطور که افزودن کاتالیزور به واکنش های شیمیایی سرعت انجام واکنش را زیاد می کند، آنزیم ها نیز موجب افزایش سرعت واکنش های بیوشیمیایی می شوند.
در بدن ما روزانه میلیون ها واکنش بیوشیمیایی صورت می پذیرد. در واکنش های بیوشیمی در صورت عدم حضور کاتالیزور یا آنزیم انرژی زیادی مصرف می گردد. بنابراین مطالعه بیوشیمی آنزیم ها و نحوه عملکرد آن ها از مسائل بسیار مهم در علم و صمعت است. با شناخت سازوکار آنزیم ها می توان از آن ها در بخشهای دیگر صنعت استفاده نمود.
فهرست آنزیم ها
- اکسید و ردوکتازها
این آنزیم ها کاتالیز واکنش های اکسیداسیون و احیا (اکسایش کاهش) را بر عهده دارند.
- ترانسفرازها
ترانسفراز ها آنزیم هایی هستند که وظیفه انتقال مولکول هایی همچون فسفات، آمین و… را از مولکول به مولکول دیگر بر عهده دارند. آمینوترانسفرازها نمونه ای از این آنزیم ها هستند که منتقل کننده گروه آمین هستند.
- هیدرولازها
این آنزیم ها به واکنش های آبکافتی را کاتالیز می کنند. مثلا پپتیداز ها نمونه ای از هیدرولاز ها هستند که موجب شکستن پیوندهای پپتیدی می شوند.
- لیازها
لیازها قادرند تا گروه های ویژه ای را از مولکول ها جدا کنند. برای مثال دکربوکسیلازها قادر به برداشتن دی اکسید کربن هستند.
- ایزومرازها
ایزومرازها موجب کاتالیز تشکیل ایزومرها می شوند.
- لیگازها
لیگازها واکنش هایی را کاتالیز می کنند که از اتصال دو مولکول به وسیله پیوند کوالانسی ترکیب جدیدی سنتز می گردد. ساخته شدن استیل کو آنزیم A نمونه ای از این واکنش هاست.
سینتیک آنزیمی در بیوشیمی آنزیم ها
درواقع سینتیک آنزیمی شاخه ای از علم بیوشیمی آنزیم ها است. سینتیک آنزیمی با اندازه گیری کمی سرعت واکنش های آنزیمی و همین طور مطالعه اصولی عوامل موثر بر سرعت آن ها مرتبط است. هنگام ترکیب آنزیم با سوبسترا چهار مرحله یا چهار فاز حاصل می آید.
فاز تاخیری یا lag time زمانی است که طول می کشد تا سوبسترا روی آنزیم جای خود را پیدا کند. در این فاز هیچ محصولی تولید نخواهد شد.
در فاز درجه صفر سوبسترا در جایگاهش قرار گرفته و مقدار آن زیاد است. به دلیل زیادی سوبسترا در این مرحله، واکنش رفت بر واکنش برگشت غالب است و محصولات خیلی زیاد نیستند.
در فاز مخلوط مقدار محصولات به اندازه ای زیاد می شوند که خود محصولات بهصورت سوبسترا عمل کرده و واکنش برگشت انجام خواهد شد.
در نهایت فاز تعادلی است که در آن سرعت واکنش رفت با سرعت واکنش برگشت برابر خواهد شد.
بررسی عوامل مختلف بر سرعت بیوشیمی آنزیم

دما
افزایش دما موجب افزایش سرعت واکنش های شیمیایی خواهد شد. اما تاثیر دما در واکنش های بیوشیمی آنزیمی متفاوت است. افزایش دما هم می تواند موجب افزایش سرعت واکنش های آنزیمی شود و هم می تواند موجب بر هم زدن ساختمان پروتئینی آنزیم ها گردد. که این موضوع اخیر می تواند موجب از بین رفتن فعالیت آنزیمی گردد. توجه شود که افزایش دمای بیش از ۵۰ درجه قادر است تا ساختمان پروتئینی آنزیم ها را دگرگون نماید. بهترین دما برای فعالیت بهینه آنزیم ها دمای optimum است. در این دما میزان فعالیت آنزیم ها حداکثر بوده و برای اغلب آنزیم های بدن ۳۷ درجه سانتی گراد است .
تاثیر pH بر فعالیت بیوشیمی آنزیم ها
یکی از عوامل موثر بر فعالیت آنزیم ها پی اچ است. پی اچی که هر آنزیمی در آن بیشترین فعالیت را از خود نشان دهد، پی اچ optimum نامیده می شود. برای اکثر آنزیم ها پی اچ optimum همان pH خون است، به جز آنزیم های معده که در pH اسیدی فعالیت می کنند. آنزیم کلین استراز نیز در پی اچ قلیایی فعالیت می کند.
غلظت سوبسترا
سرعت واکنش ها با افزایش میزان غلظت افزایش خواهد یافت. این سرعت تا زمانی ادامه خواهد یافت که تمام مولکول های آنزیم اشباع شده به طوریکه دیگر افزایش غلظت اثری بر سرعت نداشته باشد. در این حالت سرعت مستقل از غلظت عمل خواهد نمود. با رسم منحنی سرعت بر حسب غلظت می توان متوجه شد که یک منحنی هایپرولیک به دست می آید.
غلظت آنزیم
تا زمانی که سوبسترا به مقدار کافی در محلول موجود باشد، سرعت یک واکنش بیوشیمی آنزیمی مستقیما با غلظت آنزیم متناسب می باشد. اگر افزایش غلظت آنزیم ادامه یابد، دیگر به علت کمبود مقدار سوبسترا سرعت واکنش افزایش نخواهد یافت.
بررسی مهارکننده در بیوشیمی آنزیم ها
در ادامه این مطلب به بررسی مهار کننده ها و فعال کننده ها در بیوشیمی آنزیم ها می پردازیم. تركيباتی كه به افزايش سرعت واكنش های آنزيمی منجر می شوند، فعال كننده بوده و تركيباتی كه موجب كاهش سرعت يا توقف واكنش های آنزيمی می شوند مهاركننده هستند.
وقتی که در شرايط مطلوب دما، pH،غلظت سوبسترا و… سرعت واكنش آنزيمی كاهش يابد، درواقع آن واکنش بیوشیمیایی مهار شده است. توجه شود که اين پديده تغييری شيميايی بوده و متفاوت با كم شدن فعاليت آنزيم در اثر دناتوره شدن بوده که تغييری فيزيكی است.
نامگذاری بر اساس بیوشیمی آنزیم ها
در نامگذاری سنتی آنزیمها از روشهای مختلفی استفاده می شود. یکی از روش های نامگذاری آنزیم ها، استفاده از اسم سوبسترای آنزیم به همراه آز (ase) است.
روش دیگر نامگذاری استفاده از ماهیت آنزیم هاست. مثلا نام کاتالاز که تجزیه هیدروژن پراکسید را برعهده دارد، به سوبسترایش مرتبط نیست.
دانشمندان در سال ۱۹۶۴ میلادی به دلیل عدم روشی یکسان در نامگذاری آنزیمها، سیستمی برای طبقه بندی آنزیمها ابداع و معرفی نمودند. این سیستم عدد کمیسیون آنزیم ها نام داشته و به هر آنزیم یک کد چهار رقمی اختصاص خواهد یافت.
بیوشیمی آنزیم ها و جایگاه فعال
جایگاه فعال آنزیم بخشی از آنزیم است که واکنش دهنده به آن متصل می گردد. سوبسترا آنزیم نیز واکنش دهنده ای است که به آنزیم متصل می شود.
همان طور که پیش تر نیز اشاره شد، بیشتر آنزیمها پروتئینی بوده و از آمینواسید تشکیل گشته اند. پیچ و تاب خوردن آمینواسیدها شکل سه بعدی منحصربه فردی را به آنزیم ها می بخشد. عملکرد و شکل جایگاه فعال توسط آمینواسیدهایی صورت می پذیرد که در جایگاه فعال آنزیم هستند.
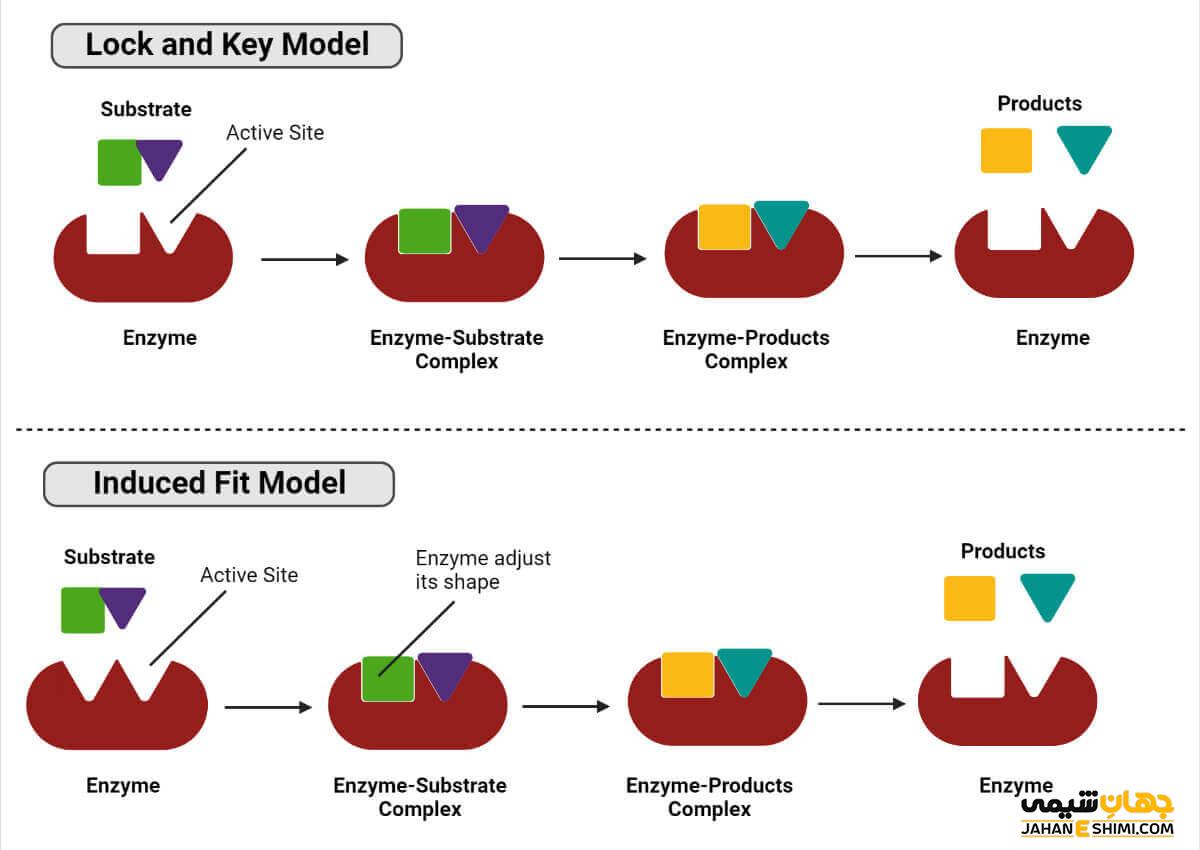
تعریف مدل قفل و کلید در بیوشیمی آنزیم ها
میلادی امیل فیشر در سال ۱۸۹۴موفق به ارائه مدل قفل و کلید شد. این مدل به شکل آنزیم و سوبسترا اشاره کرده و برطبق آن آنزیم را قفل و سوبسترا را کلید در نظر میگیرند. بر طبق این تعریف شکل ساختاری سوبسترا با شکل جایگاه فعال آنزیم مکمل است. تثبیت سوبسترا با قرار گرفتن سوبسترا در جایگاه فعال آنزیم صورت گرفته و هیچ تغییری در شکل آنزیم یا سوبسترا ایجاد نخواهد شد.
در نظر نگرفتن حالت گذار سوبسترا یکی از مشکلاتی این مدل محسوب می شود. سوبسترا در حالت گذار نه به واکنش دهنده و نه به محصول شباهتی ندارد و شکل آن نیز تغییر می کند. این نظریه به مدت ۶۰ سال پذیرفته شده بود، اما با ارائه نظریه تناسب القایی جایگزین شد.
بیوشیمی آنزیم ها و نحوه کاتالیز واکنش های بیوشیمیایی
تفاوت واکنش ها در استفاده و یا عدم استفاده از آنزیم ها، سرعت واکنش است. درواقع واکنش ها در صورت عدم حضور آنزیم ها بسیار آهسته انجام شده و امکان حیات برای موجودات زنده فراهم نخواهد بود. واکنش ها به صورت خود به خودی و بدون نیاز به فشار خارجی، صورت می پذیرند. اما استفاده از آنزیم ها با تسریع واکنش های بیوشیمیایی موجب می شود تا هزاران واکنش بیوشیمیایی در کسری از ثانیه رخ دهد.
کاربردهای صنعتی آنزیم ها
کاربرد پروتئازها
پروتئازها در شکستن پروتئین ها و پلی پپتیدها استفاده می شوند. برای حذف لکه های پروتئینی در صنعت تحت عنوان پاک کننده های بیولوژیکی از پروتئازها استفاده می شود. پروتئاز رنین از معده نشخوار کنندگان جوان به دست می آید. این آنزیم در ساخت پنیر کاربرد دارد. پروتئاز تریپسین نیز در هضم پروتئین های غذای نوزادان استفاده می گردد.
کاربرد آمیلازها
آمیلازها موجب شکستن کربوهیدارت ها می گردند. آمیلاز ها نیز دارای کاربردهای صنعتی مختلفی هستند. کاربرد به عنوان پاک کننده بیولوژیکی و حذف باقیمانده کربوهیدرات نشاسته در ظروف از کاربردهای این آنزیم محسوب می شود. آمیلاز آلفا قارچی نمونه ای از آمیلازها بوده که در ساخت آرد مورد استفاده قرار می گیرد. این آنزیم موجب تبدیل نشاسته به ترکیبات قند شده و در تولید نان های مختلف کاربرد دارد. تولید مالت از دیگر موارد استفاده از آنزیم هایی همچون آمیلاز هاست.
سخن آخر
در این مطلب از جهان شیمی فیزیک به بررسی خواص و کاربرد و اهمیت مطالعه بیوشیمی آنزیم ها پرداختیم. آنزیم ها نقش مهمی در زندگی موجودات زنده دارند. بعلاوه خواص منحصربهفرد آنزیم ها موجب شده تا از بسیاری از آن ها استفاده صنعتی شود. بیوشیمی آنزیم ها با بررسی عملکرد آنزیم ها موجب پیشرفت جوامع بشری خواهد شد.



















