
غلظت (concentration) کمیتی است که در علم شیمی برای سنجش میزان حل شدن از یک حل شونده در حلال به کار می رود.

توجه داشته باشید که غلظت را می توان با استفاده از چندین روش مختلف بیان کرد. در مباحث پیشین نشریه، مطالبی در خصوص مولاریته، مولالیته، نرمالیته، کسر مولی، غلظت معمولی و غلظت درصد ارائه شده است. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با انواع دیگر غلظت و نحوه محاسبه آنها در شیمی ارائه شده است. لطفا با ما همراه باشید.
غلظت چیست؟
غلظت، در واقع معیاری برای تعیین میزان اختلاط یک ماده، در ماده ای دیگر می باشد. از طرفی دیگر، خواص یک محلول به مقدار ماده حل شده در حلال بستگی دارد. از این رو در انجام کارهای کمی مربوط به محلول ها بایستی در ابتدا غلظت محلول را مشخص نمود.
همانند محلول ها، ترکیب نسبی یک مخلوط نیز نقشی مهم در تعیین خواص آن مخلوط دارد. در واقع میزانی از اجزای تشکیل دهنده یک مخلوط را با غلظت آن مخلوط می شناسند. بنابراین، لزوم بررسی و تعیین غلظت مواد شیمیایی در علم شیمی مانند استوکیومتری، بیش از پیش آشکار می گردد.
لازم به ذکر است که محلول ها در حقیقت مخلوطی همگن از مولکول های حلال (Solvent) و حل شونده (Solute) می باشند. حلال جزئی از یک محلول است که غلظت آن به طور واضح و مشخصی بیش از سایر اجزای آن محلول باشد، در حالیکه حل شونده به ماده ای گفته می شود که در یک محلول، مقدار بسیار کمتری از آن نسبت به حلال وجود دارد.

واحد غلظت
برای توصیف کیفی محلول ها می توان از کلمات غلیظ و رقیق استفاده کرد. محلول غلیظ به محلولی گفته می شود که مقدار زیادی از حل شونده در میزان مشخصی از حلال وجود داشته باشد. در حالیکه، محلول رقیق به محلولی می گویند که مقادیر حل شونده در آن در مقابل مقدار مشخصی از حلال، کم باشد.
همانطور که بیان شد در کارهای کمی مربوط به محلول ها و مخلوط ها باید حتما غلظت را تعیین نمود. کمیت های زیادی برای اندازه گیری غلظت محلول ها و مخلوط ها در علم شیمی وجود دارند. در شکل زیر تعدادی از واحد های مهم غلظت به همراه فرمول آورده شده اند. در ادامه مقاله انواع دیگر روش های بیان غلظت را بررسی می کنیم.
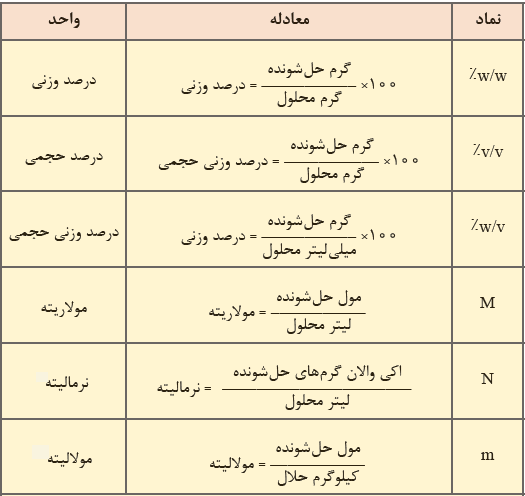
بخش در یکای سنجش
در محلول های بسیار رقیق، یعنی در محلول هایی که مقدار حل شونده در آنها بسیار کم باشد، برای بیان غلظت از قسمت در یکای سنجش (parts-per notation) استفاده می شود. از نمونه های این نوع واحد می توان به بخش در صد (pph)، بخش در هزار (ppt)، بخش در میلیون (ppm)، بخش در میلیارد(ppb)، بخش در تریلیون (ppt) و بخش در کوادریلیون (ppq) اشاره کرد. این کمیت ها به صورت نسبت مولی یا نسبت جرمی ماده مورد نظر در یک محلول سنجیده می شوند.
توجه داشته باشید که این کمیت ها بدون بعد (Dimensionless quantity) می باشند. کمیت های بدون بعد از تقسیم کردن دو کمیت با واحد های مشابه و یا تقسیم دو عبارت ریاضی با واحد های یکسان بدست می آیند. در واقع در بیان این غلظت ها، باید واحد هر دو جزء مورد نظر (یعنی حل شونده و حلال) یکسان باشد تا در نهایت یک کمیت بدون بعد داشته باشید.
لازم به ذکر است که در محلول های آبی بسیار رقیق، از آنجایی که مقدار ماده حل شونده بسیار کم است، بنابراین می توان با یک تقریب نسبتا خوب، چگالی محلول را با چگالی آب برابر در نظر گرفت (g mL-۱). در واقع یعنی جرم محلول بر حسب کیلو گرم معادل یک لیتر حجم محلول می باشد. از بین کمیت های بیان شده، قسمت در میلیون و قسمت در میلیارد در بیان غلظت محلول ها کاربرد بیشتری دارند که در ادامه مقاله، این دو کمیت را بررسی می کنیم.
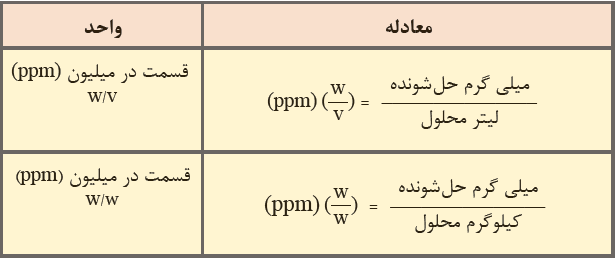
قسمت در میلیون
قسمت در ميليون (part per million) كه آن را به اختصار با ppm نشان می دهند، برابر با نسبت مقدار گرم های حل شونده به مقدار گرم های محلول ضرب در يك ميليون می باشد. در حقیقت می توان گفت که ppm نشان دهنده تعداد گرم های حل شونده در يك ميليون گرم محلول می باشد.
۱۰۶ × (جرم محلول بر حسب گرم / مقدار ماده حل شونده بر حسب گرم) = ppm
همان طور که بیان شد، در محلول های بسیار رقیق، جرم حل شونده بسيار كمتر از جرم حلال می باشد. از این رو می توان جرم محلول را تقريبا همان جرم حلال در نظر گرفت. پس چگالی محلول برابر با چگالی آب و در واقع برابر با یک کیلوگرم بر لیتر خواهد بود. با این تفاسیر می توان در رابطه ppm به جاي محلول از حلال استفاده كرد. در اين صورت خواهيد داشت :

بنابراین می توان ppm را به صورت جرم جسم حل شونده بر حسب میلی گرم در یک لیتر محلول نیز تعریف کرد. با توجه به این توضیحات مشخص می شود که یک ppm معادل با یک میلی گرم در لیتر می باشد.
یک لیتر محلول / میلی گرم حل شونده = ppm
مثلا مقدار ۴ گرم کلرید سدیم را در ۲۰۰ گرم آب حل کرده اند. غلظت کلرید سدیم را بر حسب ppm گزارش نمایید.
ppm = w / w = ppm = (4 g / 204 g) × ۱۰۶ = ۱۹.۰۶ × ۱۰۳
لازم به ذکر است که با توجه به تعریف ppm و معادله مربوطه، می توان گرم هر جزء در محلول را نیز محاسبه کرد. به عنوان مثال، چند میلی گرم پتاسیم نیترات در ۰/۴۵ کیلوگرم از محلول ppm 6۰۰ این محلول وجود دارد؟
۶۰۰ ppm = 600 mg / kg× ۰.۴۵ kg = 270 mg
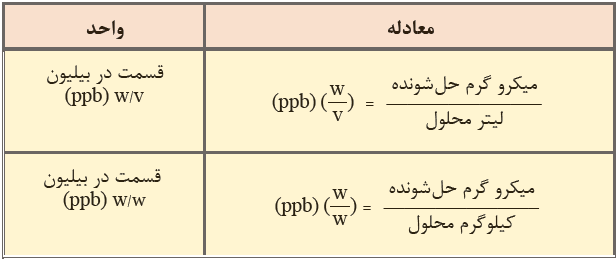
قسمت در میلیارد
قسمت در ميليارد (part per billion) كه آن را به اختصار با ppb نشان می دهند، برابر با نسبت مقدار گرم های حل شونده به مقدار گرم های محلول ضرب در يك بيليون می باشد. در حقیقت می توان گفت که ppb نشان دهنده تعداد گرم های حل شونده در يك بيليون گرم محلول می باشد.
۱۰۹ × (جرم محلول بر حسب گرم / مقدار ماده حل شونده بر حسب گرم) = ppb
مشابه محاسبات ppm در محلول های بسیار رقیق، در اینجا نیز می توان جرم محلول را تقريبا همان جرم حلال در نظر گرفت. بنابراین می توان در رابطه به جاي محلول از حلال استفاده كرد. در اين صورت خواهيد داشت :

بنابراین می توان ppb را به صورت جرم جسم حل شونده بر حسب میکرو گرم در یک لیتر محلول نیز تعریف کرد. با توجه به این توضیحات مشخص می شود که یک ppb معادل با یک میکرو گرم در لیتر می باشد.
یک لیتر محلول / میکرو گرم حل شونده = ppb
به عنوان مثال مقدار ۴ گرم کلرید سدیم را در ۲۰۰ گرم آب حل کرده اند. غلظت کلرید سدیم را بر حسب ppb گزارش نمایید.
ppb = w / w = ppm = (4 g / 204 g) × ۱۰۹ = ۱۹.۰۶ غلظت بر حسب
علاوه بر آن، با توجه به تعریف غلظت های ppm و ppb داريم:
۱۰۳ × غلظت بر حسب ppm = غلظت بر حسب ppb
عدد غلظت
این کمیت به تعداد ذرات (اتم، مولکول، یون و …) یک ترکیب به کل حجم مخلوط گفته می شود. با توجه به فرمول مشخص می شود که واحد آن به صورت یک یر متر مکعب می باشد.
Ci = Ni / V
غلظت تجزیه ای یا فرمالیته
فرمالیته (F) یا غلظت فرمال (Formal concentration) به مقدار وزن فرمولی از یک ماده حل شده بر حسب گرم در یک لیتر محلول گفته می شود.
حجم محلول بر حسب لیتر / وزن فرمول گرمی بر حسب گرم = فرمالیته
اما وزن فرمول گرمی (gFW) با کمک معادله زیر بدست می آید :
وزن مولکولی / گرم های نمونه حل شده = وزن فرمول گرمی

در مورد ترکیبات یونی همانند کلرید سدیم غلظت بر اساس فرمالیته بیان می شود. زیرا ترکیبات یونی در هنگام حل شدن در محلول های آبی به یون های مثبت و منفی تشکیل دهنده خود تفکیک می شوند، بنابراین دیگر مولکول مستقل وجود ندارد. از این جهت تعداد مول واقعی NaCl در نمونه و همچنین غلظت آن به صورت واقعی در محلول ياد شده تقريبا برابر با صفر می باشد.
در واقع غلظت فرمال نشان دهنده مقدار جسم حل شده، بدون در نظر گرفتن ترکیب واقعی یک محلول است. توجه داشته باشید که واحد فرمالیته همانند مولاریته، مول بر لیتر می باشد. تفاوت مولاریته و فرمالیته در این است که مولاریته در حقیقت غلظت یک گونه شیمیایی خاص در محلول می باشد، اما فرمالیته غلظت کل گونه در محلول است. به همین دلیل به فرمالیته، مولاریته تجزیه ای نیز گفته می شود.
لازم به ذکر است که در مولاریته وزن مولکولی گفته می شود، در حالیکه در فرمالیته وزن فرمولی. زیرا همان طور که بیان شد در ترکیبات یونی مولکول وجود ندارد بلکه یون دارید. حال اگر یک ترکیب به طور کامل به یون های تشکیل دهنده خود تفکیک نشود، مولاریته با فرمالیته برابر می شود. به طور کلی می توان گفت که فرمالیته از نظر عددی برابر یا بیشتر از مولاریته خواهد بود.
مثال
مقدار ۹۸ گرم اسید سولفوریک (H۲SO۴) را در یک لیتر محلول در نظر بگیرید. ۹۸ گرم برابر با وزن فرمولی اسید می باشد. بنابراین از تقسیم آن بر ۱ لیتر، ۱ فرمال بدست می آید. از طرفی دیگر جرم یک مول از آن نیز همان ۹۸ گرم می باشد، بنابراین مولاریته با فرمالیته این محلول یکسان و برابر می باشد. پس می توان گفت که در هنگام بیان غلظت ترکیبات یونی از فرمالیته و در مورد سایر ترکیبات از مولاریته استفاده می کنند.
عوامل موثر بر غلظت
به طور کلی می توان گفت که غلظت با تغییر فشار و دما تغییر می کند. در واقع افزایش فشار همواره باعث زیاد شدن غلظت مواد می شود. در حالیکه افزایش دما معموما غلظت ماده را کاهش می دهد.
غلظت در شیمی
غلظت میزان ماده حل شده در یک حلال است و در زمینه هایی مانند شیمی و پزشکی بسیار مهم است و بر واکنش ها و دوزها تأثیر می گذارد. غلظت اصطلاحی است که برای توصیف مخلوط ها به کار می رود و مشخص می کند که چه مقدار از یک ماده به نام املاح در ماده ای دیگر که به آن حلال می گویند حل شده است. بسته به نیاز، روشهای مختلفی برای توصیف غلظت وجود دارد که میتواند شامل وزن، حجم یا جرم مولکولی باشد.
شاید ساده ترین راه برای توصیف غلظت، وزن باشد. فردی که مایل به ساخت مخلوط ثابتی از نمک در آب است، ممکن است هر دو ماده را وزن کرده و نتایج را ثبت کند. مخلوطی که با استفاده از این روش ساخته میشود معمولاً مخلوط درصد وزنی نامیده میشود، که تعریف میکند که وزنها به جای حجم استفاده میشوند.
وزن در حجم نیز اندازه گیری رایج غلظت املاح است. مقداری از املاح ابتدا با استفاده از ترازو اندازه گیری می شود و سپس به ظرف اضافه می شود. سپس حلال به علامت حجم روی ظرف اضافه می شود و در نتیجه حجم مشخصی از مخلوط حاصل می شود. مخلوط حاصل به عنوان وزن در حجم، مانند پوند در هر گالن یا گرم در لیتر تعریف می شود.
غلظت حجمی در صورتی امکان پذیر است که هر دو ماده مایع باشند. برای اندازه گیری حجم املاح و حلال از یک ظرف علامت دار استفاده می شود، سپس آنها را مخلوط می کنند. غلظت به عنوان درصد حجمی نامیده می شود تا مشخص شود که هر دو ماده به جای وزن در حجم هستند.
برای تعیین مقدار املاح در مخلوط مولی، تعداد مول های مورد نیاز در جرم مولی ضرب می شود تا وزن حاصل شود. این وزن به یک ظرف اضافه می شود و مقدار مشخصی از حجم حلال اضافه می شود. نتیجه یک نسبت مول در حجم است که به آن غلظت مولی می گویند.



















