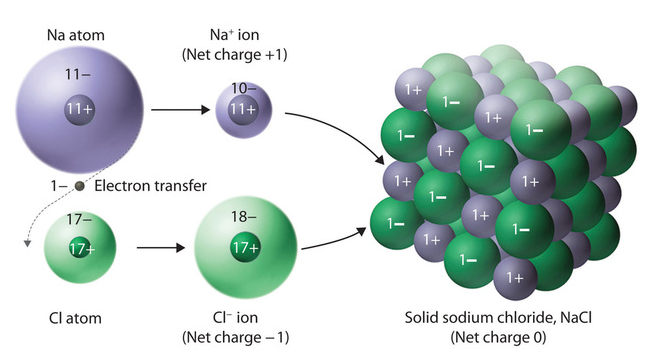
ترکیب یونی (Ionic Compound) به دسته ای از ترکیبات شیمیایی که در آن یون های مثبت و منفی با طرح معین هندسی در کنار هم قرار گرفته اند گفته می شود.

در این ترکیب جاذبه الکترواستاتیک قوی، یون های منفی ـ مثبت را در ساختار بلور در کنار یکدیگر نگه داشته است. در این نوع از ترکیبات، هیچ واحد مولکولی مشخصی وجود ندارد. در مطالب پیشین نشریه جهان شیمی فیزیک، پیوند یونی را تعریف و نحوه تشکیل آن را بیان کردیم. در این مقاله به بررسی ترکیبات یونی و ویژگی های آنها می پردازیم. لطفا همراهی بفرمایید.
ترکیب یونی
در ترکیبات یونی، اتم ها برای آنکه به آرايش گاز نجيب (آرايش هشتايی) دست یابند، الکترون های لایه ظرفیت را ميان خود انتقال می دهند. در واقع انتقال الکترون باعث تولید دو بار غیر همنام میشود. به این نوع از ترکيبات که ذرات سازنده آنها يون هایی با بار مخالف باشند ترکيب يونی يا نمک گفته می شود. در این ترکیبات، بین اتم های درگیر در پیوند، پیوند یونی تشکیل شده است.
یک ترکیب یونی معمولا از یک فلز به عنوان یون مثبت (کاتیون) و یک نا فلز به عنوان یون منفی (آنیون) تشکیل شده است. فلزات برای تکمیل آرایش الکترونی (قاعده اکتت) و رسیدن به ساختار پایدار، الکترون از دست میدهند و نافلزات الکترون جذب میکنند. در نتیجه واکنش بین فلزات با نایفلزات سبب تشکیل ترکیب یونی می شود.
ساختار ترکیب یونی
همانطور که بیان شد یون های مثبت و منفی در ترکیبات یونی با ساختار هندسی منظم در کنار یکدیگر قرار می گیرند. محققان با استفاده از علم بلورشناسی به مطالعه دقیق ساختار ترکیبات یونی پرداخته اند و توانستند بسیاری از خواص و ویژگی های این ترکیبات را توجیه کنند. ساختار یک ترکیب یونی به اندازه نسبی و بار نسبی یون های آن (کاتیون ها و آنیون ها) بستگی دارد.
آرايش يون ها در نمک ها به صورت يک الگوي تکراری است که در سرتاسر بلور تکرار مي شود. آرایش منظم کاتیون ها و آنیون ها در شبکه بلور سبب ایجاد شکل های مختلف در این بلورها می شود. توجه داشته باشید که یون ها در ساختار ترکیب یونی به گونه ای در کنار هم قرار می گیرند که نسبت به هم بیشترین جاذبه و کمترین دافعه (در واقع کمترین میزان انرژی شبکه) را داشته باشند.
وجود عناصر واسطه در ساختار بلور سبب ایجاد بلورهای رنگی و زیبا می گردد به طوری که برخی از آنها به عنوان رنگدانه کاربرد دارند. رنگ این ترکیبات بسیار متنوع می باشد و به عواملی از جمله ساختار بلوری، نوع کاتیون ها، نوع آنیون ها، آب پوشیده بودن یا نبودن و یا وجود نقص در ساختار بلوری بستگی دارد.
انرژی شبکه در ترکیب یونی
انرژی شبکه در یک ساختار بلوری، جمع اثر متقابل نیروهای دافعه و جاذبه می باشد. به عنوان مثال در ادامه واکنش بین سدیم و کلر بررسی می شود. در قدم اول مواد سدیم و کلر باید به اتم های مربوطه تبدیل شوند. این فرآیند نیاز به صرف انرژی دارد. در قدم بعدی جدا شدن الكترون از اتم هاي سديم نیز نيازمند صرف انرژي است. اما گرفتن الكترون به وسیله اتم هاي كلر همراه با آزاد شدن انرژي می باشد. این انرژی آزاد شده بخشی از انرژي صرف شده را جبران مي كند.
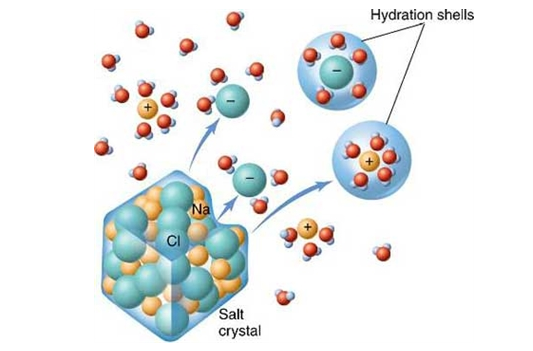
وقتی يون هاي سديم و كلر در كنار یکديگر قرار می گیرند، تشكيل ماده NaCl همراه با وجود نیرو های جاذبه (جاذبه بين يون هاي غیر همنام کلر و سدیم) و نیروهای دافعه (مثلا دافعه ابرهاي الكتريكی آنیون ها با هم) می باشد. ذکر این نکته مهم است که نيروي جاذبه تنها محدود به يک کاتيون و یا يک آنيون نمی باشد. این نیرو در تمام جهت ها و در ميان تمام يون هاي غیر همنام مجاور و یا در فواصل مختلف وجود دارد. به همین دلیل تعداد بسيار زيادي از کاتیون ها و آنیون ها به سمت يکديگر کشيده شده و آرايش منظم را بوجود می آورند.
در ترکیبات یونی نیروهای جاذبه از نیروهای دافعه بیشتر تاثیر می گذارند. بنابراین تشكيل ماده NaCl همراه با كاهش سطح انرژي پتانسيل و افزايش پايداري است. كاهش سطح انرژي پتانسيل و مقدار انرژي آزاد شده به حدی زياد است كه انرژی مصرف شده در مراحل قبل را هم جبران مي كند.
نکته: انرژی شبکه در واقع معیار مناسبی برای اندازه گیری قدرت پیوند یونی می باشد. انرژی شبکه یک ترکیب یونی با تغییر قدرت پیوند یونی تغییر می کند. هر چه بار یون بیشتر و شعاع آن کوچکتر باشد، پیوند یونی تشکیل شده قوی تر می باشد. از طرفی زمانیکه الکترونگاتيویته اتم های درگیر در پیوند، اختلاف بيشتری داشته باشند پيوند يونی قوی تر تشکیل می دهند. در اینصورت جدا کردن یون ها از یکدیگر سخت تر میشود و انرژی شبکه ترکیب یونی حاصله بیشتر می باشد.
خواص و ویژگی های ترکیبات یونی
بعد از آشنایی مختصر با ساختار و نحوه تشکیل ترکیبات یونی، خواص و ویژگی های ترکیبات یونی را بررسی میکنیم.
خواص فیزیکی ترکیبات یونی
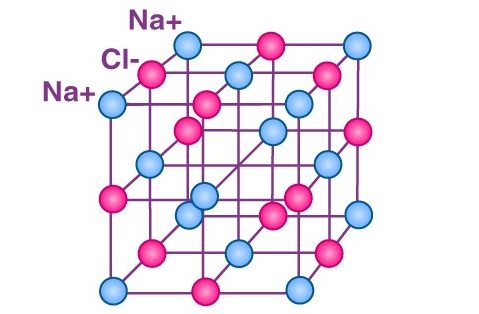
نیروهای جاذبه بین کاتیون ها و آنیون ها، در ترکیبات یونی بسیار زیاد است، به همین دلیل ترکیبات یونی، جامد می باشند و به آنها جامد یونی نیز گفته می شود. این نیروهای جاذبه در سه بعد از فضا گسترش می یابند، بنابراین جامد های یونی شکل های هندسی سه بعدی منظمی می سازند که به آنها بلور یا شبکه بلور نیز می گویند.
اعداد کوئوردیناسیون در ترکیب یونی
عدد کوئوردیناسیون یا عدد هم آرایی در بلور شناسی، به تعداد اتم ها یا یون هایی که در مجاورت اتم مرکزی در ساختار بلوری قرار دارند گفته می شود. در پیوند های یونی، به دلیل عدم وجود الکترون های اشتراکی نیروی دافعه ای وجود ندارد. بنابراین، یون های مثبت و منفی تا حد ممکن به یکدیگر نزدیک شده و جمع می شوند. این امر سبب میشود تا اعداد هم آرایی بالاتری داشته باشیم. به عنوان نمونه در NaCl هر یون دارای ۶ پیوند می باشد و یا عدد کوئوردیناسیون در CsCl برابر با ۸ است.
هدایت الکتریکی ترکیبات یونی
ترکیبات یونی در حالت جامد، به دلیل جاذبه قوی بین یون های غیر همنام، فقط می توانند در مکان های خود حرکت ارتعاشی داشته باشند. بنابراین الکتریسیته را از خود عبور نمی دهند. اما در حالت مذاب یا محلول که یون ها آزادانه به حرکت در می آیند، هادی خوب برای جریان الکتریسیته می باشند.
سختی، شکنندگی و چکش خواری ترکیبات یونی
ترکیبات یونی سخت و شکننده اند. سختی ترکیبات یونی به علت پیوند محکم میان یون های مثبت و منفی است. اگر بر اثر ضربه، ردیفی از یون ها جابجا شوند (حتی اگر یک یون در هر جهت حرکت کند)، بارهای همنام در کنار یکدیگر قرار گرفته و نیروی دافعه شدید میان آنها به وجود می آید. از طرفی چون دیگر نیروی جاذبه ای درکار نیست بلور شکسته و متلاشی می شود.
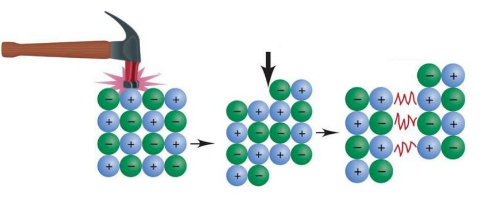
این ترکیبات چکش خوار نیز نیستند. بنابراین نمی توان با چکش کاری آنها را به ورقه های نازک تبدیل کرد. با اعمال ضربه و فشار، بلور نمک به قطعات کوچک تر شکسته و در نهایت خرد می شود.
نقطه ذوب و جوش ترکیب یونی
به دلیل نیروی جاذبه قوی میان یون های ناهمنام در جامد های یونی، انرژی بسیار زیادی نیاز است تا یون های نا همنام از یکدیگر جدا شوند و امکان حرکت آزادانه را پیدا کنند. بنابراین این ترکیبات، دمای ذوب و جوش بالایی دارند.
انحلال پذیری ترکیب یونی
ترکیبات یونی به طور کلی در حلال های قطبی مانند آب یا مایعات یونی، انحلال پذیری بالایی دارند. اما انحلال پذیری آنها در حلال های غیر قطبی کاهش می یابد. این ترکیبات به هنگام حل شدن در آب، به یون های سازنده خود تفکیک میشوند.
خاصیت اسیدی و بازی
آن دسته از ترکیبات یونی که کاتیون هیدروژن داشته باشند خاصیت اسیدی، و ترکیباتی که شامل آنیون های −OH و یا −O۲ باشند خاصیت بازی نشان می دهند.
کاربرد های ترکیبات یونی
ترکیبیات یونی کاربرد های فراوان در صنایع مختلف دارند. از جمله می توان به صنعت خوراکی (به عنوان مکمل خوراکی، نمک طعام، معطرکننده، تحریک کننده، در فرآورده های گوشتی مانند سوسیس و کالباس، نگه دارنده، طعم دهنده و عامل تخمیر مانند جوش شیرین و بیکینگ پودر)، صنعت دارویی (به عنوان تامینکننده برخی ریز مغذی ها، تبدیل داروی نا محلول به داروی محلول در آب) و صنعت رنگرزی و رنگ سازی اشاره کرد. همچنین این ترکیبات به عنوان ماده اولیه برای تولید محصولات دیگر، فرآوری بسیاری از فلزات، تولید باتری، تولید الکتریسیته، تولید پیلهای الکتروشیمیایی نیز کاربرد دارند.
انواع ترکیبات یونی
این ترکیبات شامل نمک ها، سولفید ها، اکسید ها، هیدروکسید ها و بسیاری دیگر از ترکیبات معدنی می باشند. اما به طور کلی می توان به دو دسته ترکيبات يونی دو تايی و ترکيبات يونی چند تايی تقسیم بندی کرد.
ترکيبات يونی دو تايی
به ترکيبات یونی متشکل از دو عنصر گفته می شود. در این ترکیبات معمولا یک فلز (با انرژی یونش پایین) با یک نافلز (با الکترونگاتیویته بالا) درگیر پیوند یونی می شوند. به عنوان مثال نمک طعام (NaCl) را در نظر بگیرید که تنها از دو عنصر سدیم و کلر تشکیل شده است. همانطور که در مقاله پیوند یونی اشاره شد، تمامی فلزات قادر به شرکت در پیوند یونی و در نتیجه تشکیل ترکیب یونی نیستند. معمولا فلزات گروه های یک، دو و سوم اصلی به همراه لانتانید ها و اکتینید ها در جدول تناوبی، ترکیب یونی تشکیل می دهند.
ترکيبات يونی چند تايی
به ترکیبات یونی که از یون های چند اتمی (از دو يا چند اتم يکسان يا متفاوت) تشکيل شده است، ترکیبات یونی چندتایی گفته می شود. به عنوان مثال می توان به سولفات پتاسيم (K۲SO۴)، کربنات کلسیم (CaCO۳) و نیترات آمونیوم (NH۴NO۳) اشاره کرد.
چگونگی نوشتن فرمول های شیمیایی
فرمول شیمیایی یک ترکیب یونی را با استفاده از ساده ترین نسبت کاتیون ها به آنیون های مختلف که از نظر الکتریکی خنثی باشد نشان میدهند. به این نسبت ساده سلول واحد گفته می شود. طریقه فرمول نویسی به این صورت است که:
۱- نشان شیمیایی کاتیون ترکیب مورد نظر در سمت چپ و نشان شیمیایی آنیون آن در سمت راست نوشته می شود.
۲- بار هر یون در ترکیب مورد نظر را به صورت زیروند در سمت راست یون دیگر آن ترکیب قرار می دهند.
۳- اگر امکان پذیر باشد زیروند ها را با یکدیگر ساده می کنند و از نوشتن یک زیروند خودداری می شود.
لازم به ذکر است که اگر کاتیون مورد نظر بیشتر از یک نوع کاتیون تولید می کند، باید بار آن را با اعداد رومی و داخل پرانتز در جلوی نام آن کاتیون مشخص کرد.
نامگذاری ترکیبات یونی
به طور کلی برای نام گذاری این ترکیبات، نخست نام کاتیون و سپس نام آنیون آن با پسوند “ید” نوشته می شود. به عنوان مثال نام ترکیب NaBr سديم برميد می باشد.
برخي از فلزات اصلي و بيشتر فلزات واسطه كاتيون هایی با بارهاي مختلف ايجاد می نمايند. بنابراین بر طبق قواعد نامگذاری آيوپاك، باید بار هر كاتيون به صورت عدد رومی داخل پرانتز در جلوی نام آن کاتیون ذكر شود. به عنوان مثال آهن می تواند کاتیون های دو بار مثبت و سه بار مثبت ایجاد کند، بنابراین نام ترکیب FeO به صورت آهن (II) اكسيد می باشد.
در صورتیکه در ترکیب یونی مورد نظر کاتیون یا آنیون به صورت چند اتمی باشد از نام یون چند اتمی برای نام گذاری استفاده میشود. به طور مثال، ترکیب NaHCO۳ موسوم به سديم هيدروژن كربنات يا سديم بيكربنات است. لازم به ذکر است که برخی از یون های چند اتمی نامی متداول دارند که هنگام نام نویسی آنها نام متداول به کار برده می شود.
تفاوت ترکیب یونی و مولکولی
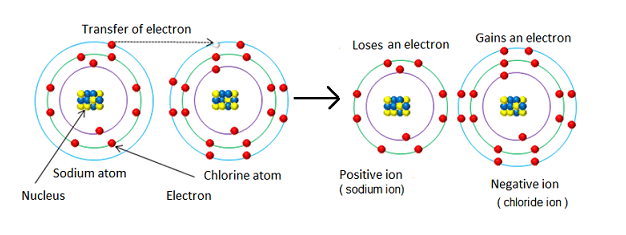
هنگامی که بین کاتیون و آنیون پیوند ایجاد می شود، آن را پیوند یونی می نامیم. پیوندهای یونی زمانی اتفاق میافتند که کاتیون الکترونهایی را به آنیون اهدا میکند تا هر دو بتوانند یک پوسته بیرونی کامل داشته باشند. پیوند یونی یک جاذبه الکترواستاتیکی بین دو یون با بار مخالف است که وقتی یک اتم الکترون ها را به دیگری منتقل می کند، ایجاد می شود.
به عنوان مثال، هنگامی که سدیم (Na) با کلر (Cl) پیوند می زند تا ترکیب NaCl را بسازد، یون سدیم (Na+) یک الکترون به یون کلر (Cl-) اهدا می کند. سدیم یک الکترون ظرفیت دارد، در حالی که کلر دارای هفت الکترون ظرفیت است. هر دوی آنها می خواهند یک پوسته بیرونی کامل داشته باشند و پایدارتر شوند. بنابراین، سدیم از تک الکترون خود در لایه بیرونی خلاص می شود و آن را به کلر می دهد زیرا کلر برای پر کردن بیرونی ترین لایه خود به یک الکترون نیاز دارد.
اکنون که با ساختار و خواص ترکیبات یونی آشنا شدیم، بیایید ببینیم که چه ترکیبات مولکولی چگونه با ترکیبات یونی تفاوت دارند. هنگامی که نافلزات توسط پیوندهای کووالانسی به یکدیگر متصل می شوند، ترکیبات مولکولی را تشکیل می دهند. پیوند کووالانسی به جای اینکه کاتیون الکترون های خود را به یک آنیون بدهد، پیوند کووالانسی شامل اشتراک الکترون های ظرفیت بین دو اتم است.
ترکیبات مولکولی ترکیباتی هستند که توسط پیوندهای کووالانسی به هم متصل می شوند. پیوندهای کووالانسی پیوندهایی هستند که توسط یک جفت الکترون مشترک تشکیل می شوند. برای درک بهتر نحوه تشکیل پیوندهای کووالانسی نافلزات، اجازه دهید به CO2 نگاه کنیم. کربن دارای چهار الکترون ظرفیتی و اکسیژن دارای شش الکترون ظرفیتی است. در اینجا، یک اتم کربن به دو اتم اکسیژن پیوند می زند و دی اکسید کربن CO2 را تشکیل می دهد. هر دوی آنها می خواهند پوسته بیرونی کامل (۸ الکترون) داشته باشند، بنابراین الکترون ها را بین آنها به اشتراک می گذارند



















