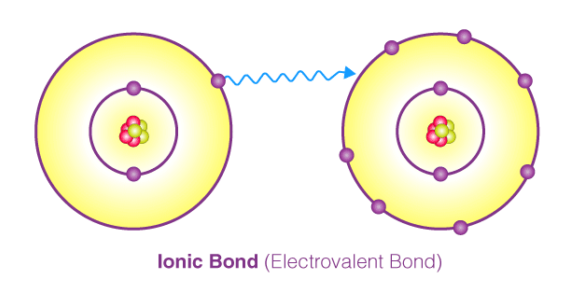
پیوند یونی (Ionic Bond) یا پیوند الکترووالانسی (Electrovalent Bond) یکی از انواع پیوندهای شیمیایی می باشد. این پیوند از انتقال الکترون بین اتم های درگیر در پیوند ایجاد می شود و در آن، اتم ها به صورت یون های منفی و مثبت در می آیند. در واقع در این نوع پیوند، یون های مثبت و منفی با نیروی جاذبه الکتروستاتیک قوی در ساختار بلور در کنار هم قرار می گیرند. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با پیوند یونی ارائه شده است. لطفا همراهی بفرمایید.
فهرست مطالب این مقاله
۱- تعریف پيوند يونی
۲- تشکیل پيوند يونی
۳- عوامل موثر بر قدرت پیوند یونی
۴- گروه های شرکت کننده در پیوند یونی
تعریف پیوند یونی
پيوند يونی به دلیل جاذبه الکتروستاتیک بين يون های غیر همنام (كاتيون و آنيون) تشکیل می شود. در این پیوند انتقال الكترون بین یک اتم یا مجموعه ای از اتم هایی که با پیوند کووالانسی به هم متصل اند انجام می شود. به انتقال الکترون در بین اتم ها، الکترووالانس (Electrovalence) گفته می شود که می توان گفت مقابل مفهوم کووالانس (Covalent) می باشد.
دلیل انجام پیوند های یونی این است که اتم ها تمایل دارند که با رسیدن به آرایش گاز های نجیب (قاعده اکتت) به ساختار پایدار دست یابند. اتم هایی که در لایه ظرفیت خود تعداد کمی الکترون دارند، می توانند آن الکترون ها را به راحتی از دست بدهند و در مقابل اتم هایی که لایه ظرفیت شان تقریبا پر می باشد می توانند الکترون جذب نمایند. در این صورت هر دو اتم شرکت کننده در پیوند دارای یک لایه ظرفیت پر (هشت تایی) خواهند شد.
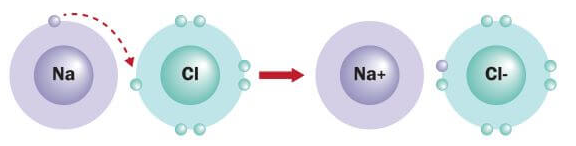
در تشکیل پيوند الکترووالانسی معمولا یک اتم الکترون گرفته و اتم دیگر آن الکترون را از دست می دهد، اما ممکن است مجموعه اي از اتم ها، الكترون بگيرند یا از دست بدهند. در واقع كاتيون ها و آنيون ها مي توانند تك اتمي و یا چند اتمي باشند. به عنوان مثال کاتیون +Mg۲، یک کاتیون تک اتمی است در حالیکه +Hg۲۲ یک کاتیون دو اتمی و +NH۴ یک کاتیون پنج اتمي محسوب می شود. یا مثلا –F یک آنیون تک اتمی است، اما آنیون های –SO۴۲ و –C۲H۳O چند اتمی می باشند.
تشکیل پیوند یونی
پيوند الکترووالانسی می تواند بين فلزات و نافلزات با یکدیگر (مانند FeCl۲ که متشکل از یون های +Fe۲ و –Cl است)، بین دو نافلز (مانند PCl۵ كه متشكل از يون های +PCl۴ و –PCl۶ است) و یا حتی بین دو فلز (مانند CsAu كه متشكل از يون هاي –Au و +Cs است) تشکیل شود. اما معمولا عناصر غیر فلزی با یکدیگر پيوند كووالانسی و عناعر فلزی با یکدیگر پيوند فلزی تشکیل می دهند.
بنابراين می توان گفت که پيوند الکترووالانسی به طور معمول بين فلزات و نافلزات تشکیل مي شود. زیرا تمایل زیاد فلزات به از دست دادن الکترون و همچنین تمايل بالای نافلزات برای گرفتن الكترون سبب سهولت در ايجاد يون ها مثبت و منفی و در نتیجه تشکیل پیوند یونی می گردد.
در هنگام تشکیل پیوند الکترووالانسی، فلزات (دارای یک تا گاهی اوقات ۴ الکترون در لایه والانس) با از دست دادن الکترون های لایه ظرفیت خود به یون مثبت (کاتیون) تبدیل می شوند و اغلب به آرایش گاز نجیب قبل از خود دست می یابند. اما نا فلزات (دارای چهار تا هفت الکترون در لایه والانس) با گرفتن الکترون به یون منفی (آنیون) تبدیل می شوند و به آرایش گاز نجیب بعد از خود دست می یابند. با انتقال الکترون، تعداد الکترون ها دیگر با بار هسته مطابقت نمی کند. بنابراین اتم ها از لحاظ الکتریکی خنثی نبوده و دارای بار های مختلفی خواهند بود.
عوامل موثر بر قدرت پیوند یونی
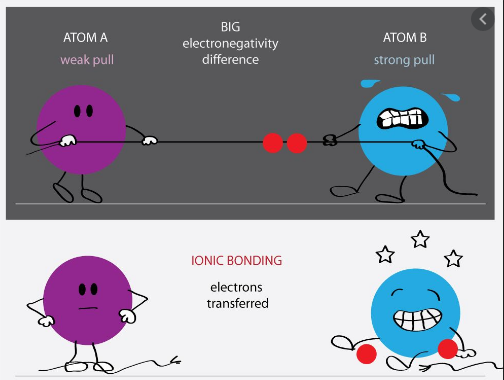
به طور کلی پیوند الکترووالانسی میان اتم هایی که اختلاف الکترونگاتیویته بین آنها زیاد باشد (حدود ۱/۷ و یا بیشتر) تشکیل می شود. توجه داشته باشید که پیوند الکترووالانسی خالص (کاملا یونی) نداریم، زیرا در هر پیوند یونی درجه ای از پیوند کووالانسی هم وجود دارد. بنابراین یک پیوند را زمانی الکترووالانسی در نظر می گیریم که خاصیت یونی بودن آن پیوند بیشتر از خاصیت کووالانسی اش باشد. هر چه اختلاف الکترونگاتیویته بین اتم های درگیر در پیوند یونی، بیشتر باشد آن پیوند یونی تر، در نتیجه قوی تر می باشد.
همان طور که می دانید، فلزات الکترونگاتیویته کم و نافلزات الکترونگاتیویته زیادی دارند، بنابراین پیوند الکترووالانسی میان عناصر فلزی (عناصر الکتروپوزتیو قوی) و غیر فلزی (عناصر الکترونگاتیو قوی) تشکیل می شود. در این صورت فلزات الکترون از دست داده و نا فلزات الکترون می گیرند.
از طرف دیگر اندازه و بار یون های شرکت کننده در پیوند الکترووالانسی نیز در قدرت پیوند تاثیر دارند. هرچه اندازه یون های شرکت کننده در پیوند کوچکتر باشد و بار یون ها نیز بیشتر، پیوند یونی تشکیل شده قوی تر میگردد. در اینصورت جدا کردن یون ها از یکدیگر سخت تر میشود و انرژی شبکه ترکیب یونی حاصله بیشتر می باشد.
گروه های شرکت کننده در پیوندهای یونی
عناصر گروه اول (فلزات قلیایی) تنها یک الکترون در لایه ظرفیت خود دارند. زمانیکه هر یک از این فلزات یک الکترون را از دست بدهند تا لایه خارجی آنها کامل شود، جز باقیمانده به آرایش گاز نجیب متناظر خود دست پیدا می کند. به عنوان مثال لیتیم با از دست دادن یک الکترون آرایش گاز نجیب هلیم را پیدا کرده و تبدیل به کاتیون +Li می شود.
عناصر گروه دوم (فلزات قلیایی خاکی) و عناصر گروه سوم به ترتیب دو و سه الکترون در لایه ظرفیت خود دارند. بنابراین اتم های این فلزات باید دو و یا سه الکترون از دست بدهند تا لایه خارجی آنها کامل شود، بنابراین کاتیون های دو بار مثبت و سه بار مثبت ایجاد می کنند (مانند +Ca۲ و +Al۳). کاتیون های ایجاد شده آرایش الکترونی یکسان با گاز نجیب متناظر را دارند. عناصر فلزات واسطه نیز با از دست دادن الکترون می توانند در پیوند یونی شرکت کنند.
عناصر گروه ششم (کالکوژن ها) و عناصر گروه هفتم (هالوژن ها) به ترتیب شش و هفت الکترون در لایه ظرفیت خود دارند. اتم های این عناصر غیر فلزی با گرفتن دو و یا یک الکترون از فلزات، ساختار گاز نجیب را پیدا می کنند و پایدار می شوند (مانند آنیون های –O۲ و –F).
نکته
اما ذکر یک نکته درباره فلزات مهم می باشد. فلزات بریلیم و بور که سرگروه گروه های دوم و سوم جدول تناوبی می باشند توانایی تشکیل پیوند الکترووالانسی را ندارند. این دو فلز شعاع بسیار کوچکی دارند، بنابراین لایه ظرفیت به هسته اتم بسیار نزدیک بوده و هسته اجازه از دست دادن الکترون های لایه والانس و تشکیل کاتیون را نمی دهد. در واقع این دو فلز به دلیل کوچک بودن تحمل بار مثبت را ندارند. بنابراین تنها می توانند الکترون ها را به اشتراک گذاشته و در نتیجه ترکیبات کووالانسی و نه ترکیبات یونی را تشکیل دهند.
از طرفی دیگر توجه داشته باشید که عنصر آلومینیوم تنها با آنیون های اکسیژن، فلور و سایر آنیون های اکسیژن دار ترکب یونی تشکیل می دهد. همچنین اگر توجه کرده باشید در گروه های بالا از عناصر گروه چهارم جدول تناوبی صحبتی نشده است. زیرا ترکیبات عناصر گروه چهارم مانند کربن و سیلیسیم، کووالانسی می باشند.