به میزان تمایل نسبی یک اتم برای کشیدن الکترون های پیوندی به سمت هسته خود، الکترونگاتیویته یا الکترونگاتیوی (Electronegativity) گفته می شود. فاصله الکترون های لایه آخر از هسته اتم نقش مهمی در الکترونگاتیویته بازی می کند. تمایل عناصر به گرفتن یا دادن الکترون های ظرفیت متفاوت می باشد. عنصری که به گرفتن الکترون تمایل بیشتری داشته باشد الکترونگاتیوتر خواهد بود. در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با الکترونگاتیویته ارائه شده است. لطفا همراهی بفرمایید.
تعریف الکترونگاتیویته
اتم های مختلف در جدول تناوبی به دلیل اختلاف در بارهای هسته ای، و قطعا اثر پوششی و حفاظتی هسته بر روی لایه های داخلی، تمایل متفاوتی به الکترون های اتم همسایه نشان می دهند. توانایی یک عنصر برای جذب و نگه داشتن الکترون ها را الکترونگاتیویتی می نامند. توجه داشته باشید که الکترونگاتیویته خاصیت یک اتم منفرد نیست، بلکه خاصیت یک اتم شرکت کننده در یک پیوند است. الکترونگاتیوی، به روش های مختلفی تعریف شده است که تعدادی از آنها، در ادامه توضیح داده میشوند.
الکترونگاتیویته پاولینگ
متداول ترین مقیاس که مبتنی بر مقادیر تجربی انرژی های پیوندی می باشد مقیاس پاولینگ است. همان طور که می دانید پیوند کووالانسی میان دو اتم متفاوت و ناجور هسته (مثلا پیوند A–B) قویتر از میانگین قدرت پیوند های اتم های جور هسته A–A و B–B می باشد. میزان انرژی اضافی، به قدر مطلق بار جزئی و اختلاف الکترونگاتیوی دو اتم درگیر در پیوند وابسته است. پاولینگ با انجام یکسری معادلات ریاضی توانست مقدار الکترونگاتیویته اتم ها را محاسبه کند.
الکترونگاتیویته آلرد-روکر
بر طبق این تعریف، عناصری که بار هسته ای موثر بزرگ و شعاع کوالانسی کوچکی داشته باشند، الکترونگاتیویته بیشتری نشان می دهند. این عناصر در نزدیکی اتم فلوئور در جدول تناوبی قرار گرفته اند. در این روش برای تشخیص الکترونگاتیوی از میدان الکتریکی بر سطح اتم استفاده شده است.
الکترونگاتیویته مولیکن
مولیکن فرض کرد که توزیع الکترون ها در طی تشکیل پیوند، به صورتی انجام می شود که در آن یک اتم به کاتیون و اتم دیگر به آنیون تبدیل شود. در واقع الکترونگاتیویته را بر پایه و اساس داده های بدست آمده از طیف های اتمی تعریف کرد.
مفهوم الکترونگاتیویته و نسبی بودن آن
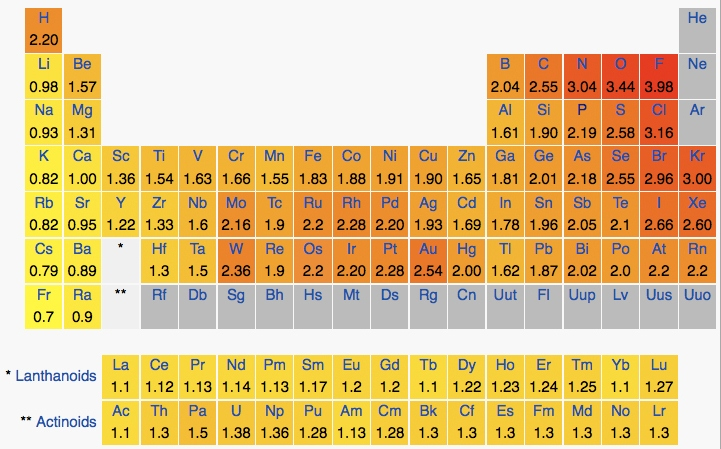
متاسفانه روشی ساده و مستقیم برای اندازه گیری الکترونگاتیویته وجود ندارد. در واقع اعداد پیشنهادی به الکترونگاتیوی اتم ها دقیق نبوده و نسبی می باشند. در این مقیاس نسبی، به الکترونگاتیوترین عنصر (اتم فلوئور)، الکترونگاتیویته ۴ نسبت داده شده است. بنابراین الکترونگاتیویته سایر اتم ها نسبت به اتم فلوئور به صورت نسبی محاسبه میشود.
نکته مهم اینست که در این مقیاس، به دلیل اینکه گازهای نجیب به تعداد کافی ترکیب های شیمیایی تشکیل نمی دهند، عددی برای آنها در نظر گرفته نشده است. علاوه بر آن در مقادیر الکترونگاتیوی عناصر، اعداد منفی نداریم.
آیا الکترو نگاتیویته یک عنصر همیشه مقداری ثابت است؟
همان طور که بیان شد مقدار الکترونگاتیوی اتم ها دقیق نمی باشد و یک مفهوم نیمه کمی محسوب می شود. زیرا مقدار الکترونگاتیویته یک اتم علاوه بر ساختمان آن اتم به عوامل دیگری از جمله به تعداد و ماهیت اتم های متصل به آن و همچنین به وضعیت اوربیتال های اتم (نوع هیبریداسیون اوربیتال ها) نیز بستگی دارد. به عنوان مثال احتمالا الکترونگاتیوی فسفر در مولکول PCl۵ با الکترونگاتیوی آن در مولکول PCl۳ تفاوت دارد.
از طرفی دیگر اتم کربن را در ترکیباتی نظیر CH۴ ،CHCl۳ ،CHBr۳ و CHCl۳CH۳ در نظر بگیرید. در تمامی این ترکیبات هیبریداسیون اوربیتال های اتم کربن، SP۳ می باشد، اما میزان قطبیت پیوندهای اطراف اتم کربن متفاوت اند. بنابراین میزان بار الکتریکی القایی بر روی اتم کربن متفاوت می باشد و الکترونگاتیویته کربن در هر یک از آنها با یکدیگر تفاوت دارد.
درباره اوربیتال های هیبریدی تنها به ذکر این نکته بسنده می کنیم که هر چه سهم اوربیتال S در هیبریداسیون بیشتر باشد الکترونگاتیویته نیز بیشتر خواهد بود. به هر حال الکترونگاتیوی اتم ها را معمولا به عنوان یک عدد ثابت در نظر می گیرند اما توجه داشته باشید که نباید مقادیر الکترونگاتیویته را مبنای محاسبات دقیق قرار داد.
تغییرات الکترونگاتیویته عناصر
به طور کلی می توان گفت که الکترونگاتیویته عناصر با افزایش تعداد الکترون های لایه ظرفیت و در نتیجه افزايش بار موثر هسته و همچنین کاهش اندازه اتم افزایش می یابد. تفاوت مقدار الكترونگاتيويته عناصر در دوره نسبت به تفاوت الكترونگاتیویته آنها در گروه بیشتر می باشد. این تغییرات را در دو دسته مجزا بررسی می کنیم.
تغییرات الکترونگاتیویته عناصر در یک دوره
در یک دوره از جدول تناوبی و با افزايش عدد اتمي، اندازه شعاع كووالانسی اتم به تدريج كاهش يافته، بنابراین مقدار بار موثر هسته آن به تدريج افزایش می یابد. هر دو عامل ذکر شده سبب بیشتر شدن الكترونگاتيوی اتم ها می شود. در نتیجه در طول هر دوره و با حرکت از سمت چپ جدول به سمت راست، الكترونگاتيوی اتم ها به تدريج افزايش می يابد.
از طرفی، تفاوت بين اندازه شعاع كووالانسی عناصر واسطه هر دوره، نسبتا پایین است، بنابراین اختلاف الكترونگاتيوی بين آنها زیاد چشمگير نمی باشد.
تغییرات الکترونگاتیویته عناصر در یک گروه
در یک گروه از جدول تناوبی و با افزايش عدد اتمی، به طور همزمان اندازه شعاع كووالانسی اتم و مقدار بار موثر هسته آن افزايش می يابد. دو عامل اصلی موثر بر الكترونگاتيوی در اینجا در جهت عکس یکدیگر عمل می کنند. اما، در واقع ميزان افزايش شعاع كووالانسی عناصر بر میزان افزايش مقدار بار موثر هسته آنها غلبه دارد، بنابراین با افزايش عدد اتمي الكترونگاتيوی عناصر در یک گروه کاهش می یابد. در مورد عناصر واسطه نیز همین روند مشاهده می شود، یعنی با افزايش عدد اتمي الكترونگاتيوی كاهش مي يابد.
کمترین و بیشترین میزان الکترونگاتیویته
به طور کلی در جدول تناوبی، در هر دوره از چپ به راست، الکترونگاتیویته افزایش و در هر گروه از بالا به پایین کاهش پیدا میکند. بنابراين بدون در نظر گرفتن گازهاي نجيب، الكترونگاتيوترين عناصر، در گوشه بالای سمت راست جدول تناوبی و كمترين الكترونگاتيوی مربوط به عناصری است که در گوشه پايين سمت چپ جدول قرار گرفته اند. بر این اساس اتم فلوئور دارای بیشترین الکترونگاتیوی و اتم سزیم کمترین الکترونگاتیوی را در بین عناصر دارند.
الکتروپوزیتیویته
به توانایی یک عنصر در از دست دادن الکترون ها الکتروپوزیتیویته گفته می شود، بنابراین این خاصیت متضاد خاصیت الكترونگاتيویته می باشد. این خاصیت از ویژگی های فلزات محسوب می شود، و تمایل به تشکیل کاتیون را نشان می دهد. هرچه خصوصیات فلزی یک عنصر بیشتر باشد، الکتروپوزیتیوتر است.
فلزات گروه اول (فلزات قلیایی) تنها یک الکترون در لایه ظرفیت خود دارند، این الکترون از هسته فاصله داشته و جاذبه کمی از هسته را احساس می کند، پس به راحتی جدا می شود. بنابراین الکتروپوزیتیوترین عناصر، فلزات قلیایی می باشند. در واقع این فلزات انرژی یونش پایینی دارند.
روند تغییرات الکتروپوزیتیویته در جدول تناوبی کاملا برعکس روند تغییرات الکتروپوزیتیوی می باشد. در حقیقت الکتروپوزیتیویته در امتداد یک دوره از سمت چپ به راست کاهش یافته و در طول یک گروه با افزایش شعاع کووالانسی افزایش می یابد.
کاربردهای الکترونگاتیویته
۱- از مقادیر الکترونگاتیویته برای تعیین میزان واکنش پذیری فلزات و نا فلزات استفاده می شود. همان طور که می دانید الکترونگاتیویته غیر فلزات زیاد است، بنابراین تمایل قوی برای جذب الکترون های والانس دارند. از طرف دیگر الکترونگاتیوی فلزات پایین می باشد و بر طبق آن جاذبه کمی برای الکترون های والانس نشان می دهند. برای پیشگویی واکنش پذیری عناصر، دانستن موقعیت عنصر در جدول تناوبی مفید است.
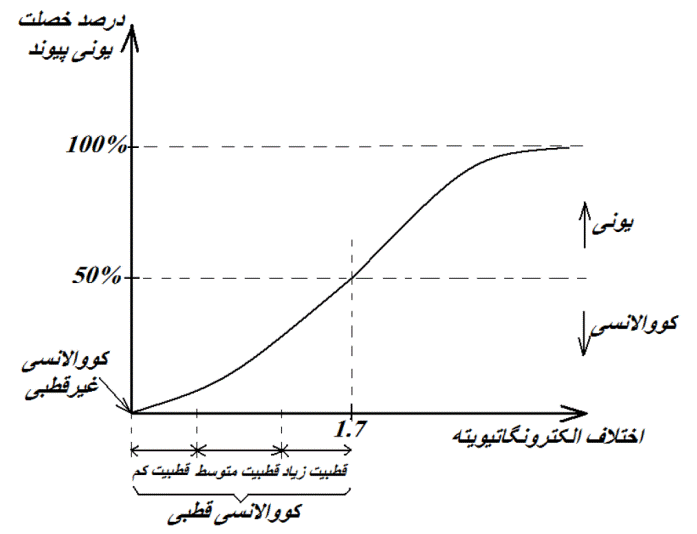
۲- از مقادیر الکترونگاتیویته برای پیش بینی و تعیین نوع پیوند های یک ترکیب استفاده می کنند. اگر اختلاف الکترونگاتیوی دو عنصری که با هم ترکیب می شوند زیاد باشد (در حدود ۷/۱ و بالاتر)، ترکیب حاصله یک ترکیب یونی خواهد بود. به عنوان مثال اختلاف الکترونگانیوی دو عنصر سدیم و کلر برابر با ۳/۲ می باشد، بنابراین NaCl یک ترکیب یونی است.
۳- از مقادیر الکترونگاتیویته برای پیش بینی خصلت پیوند های کووالانسی یک ترکیب می توان کمک گرفت. در واقع اختلاف الکترونگاتیویته بین عناصر درگیر در پیوند، میزان قطبی بودن آن پیوند را نشان می دهد. اگر اختلاف الکترونگاتیوی بین دو اتم درگیر در پیوند، صفر و یا خیلی کوچک باشد (تا اختلاف ۴/۰) پیوند کووالانسی غیر قطبی در نظر گرفته می شود.
هر چه اختلاف الکترونگاتیویته بین دو اتم درگیر در پیوند، بیشتر باشد (در محدوده ۴/۰ تا ۷/۱)، پیوند کووالانسی حاصله قطبی تر خواهد بود. در این پیوند ها، اتمی که الکترونگاتیوی بیشتری دارد، جفت الکترون های پیوندی را به سمت خودش می کشد و بار جزئی منفی خواهد داشت. بنابراین در این مولکول ها یک سر مثبت و یک سر منفی وجود داشته و مولکول کووالانسی قطبی خواهیم داشت.
الکترونگاتیویته و قطبیت کلی مولکول
همان طور که در بخش قبلی بیان شد، الکترونگاتیویته میزان قطبیت پیوند های شیمیایی بین اتم های درگیر در پیوند های یک مولکول را تعیین میکند. اما عامل اصلی در تعیین قطبیت کلی یک مولکول نیست، زیرا مولکول ممکن است دارای مرکز تقارن باشد. بنابراین یک مولکول می تواند علی رغم داشتن پیوند های قطبی، مولکولی ناقطبی باشد.
از طرفی در مولکول های دو اتمی جور هسته، الکترونگاتیوی دو اتم درگیر در پیوند یکسان بوده، بنابراین تمایل اتم های دو طرف پیوند برای جذب الکترون های پیوندی برابر می باشد. در این حالت پیوند کووالانسی خالص تشکیل شده است و مولکول هم ناقطبی خواهد بود.