اوربیتال و آرایش الکترونی به زبان ساده چیست ؟
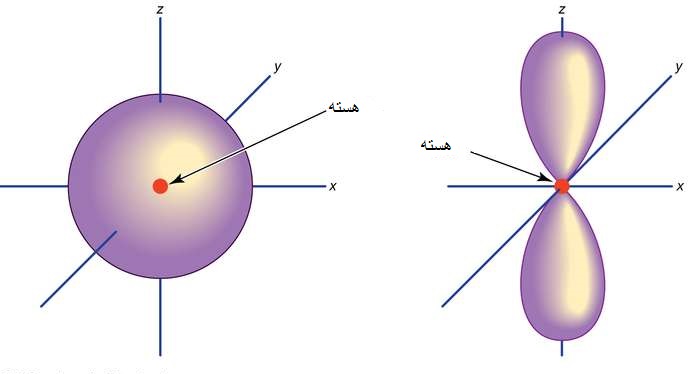
اوربیتال ناحیه ای در اطراف هسته می باشد که احتمال یافتن الکترون در آن زیاد است. به اوربیتال خانه الکترون نیز می گویند.

برای یک الکترون بر اساس تابع موجی (ψ) با حل معادله شرودینگر (مثلا برای هیدروژن) به یک سری اعداد می رسیم که به عنوان تابع موجی تعریف می شود. تابع موجی همان فضایی که احتمال یافتن الکترون در آن زیاد است را توصیف می کند که به آن اوربیتال گفته شد. این مقاله نشریه جهان شیمی فیزیک به بیان توضیحاتی راجع به اوربیتال می پردازد.
تاریخچه و مدل اوربیتالی اتم
در مورد اتم مدل های مختلفی توسط دانشمندان مختلف در گذر زمان ارائه شده است. همان طور که درمقاله نظریه اتمی به طور کامل توضیح داده شد، ابتدا جان دالتون نظریه اتمی را مطرح کرد. بعد از او تامسون مدل کیک کشمشی که در آن اتم مجموعه ای از بارهای مثبت است که بارهای منفی به طور یکنواخت بین آن ها پراکنده شده است را ارائه داد. سپس رادر فورد با انجام آزمایش معروف برخورد ذرات آلفا به ورقه طلا، نظریه وجود هسته در وسط اتم را مطرح کرد. بعد از او بور نظریه کامل تری گفت که بر طبق نظر او بار مثت اتم در مرکز هسته است اما الکترون ها روی مدارهای مشخصی با انرژی معین در اطراف هسته می چرخند.
تا اینکه شرودینگر با بیان معادله معروف خود، هم مکان الکترون و هم انرژی الکترون را با تابع موجی الکترون به هم مربوط کرد. الکترون به صورت ذره ای در حال حرکت بوده و در فضایی که ابر الکترونی غلیظ تر باشد، احتمال حضور الکترون زیاد است قراردارد.
اعداد کوانتومی
وضعیت الکترون بر اساس نظریه شرودینگر با چهار عدد کوانتومی توصیف می شود.
عدد کوانتومی اصلی (n)
این عدد ترازهای انرژی هستند که عددی صحیح بوده و الکترون ها در آن به دور هسته در چرخش هستند. به عبارتی دیگر این عدد فاصله الکترون ها از هسته را نشان می دهد و هر چه این فاصله بیشتر باشد انرژی الکترون ها بیشتر است.
عدد کوانتومی فرعی (L)
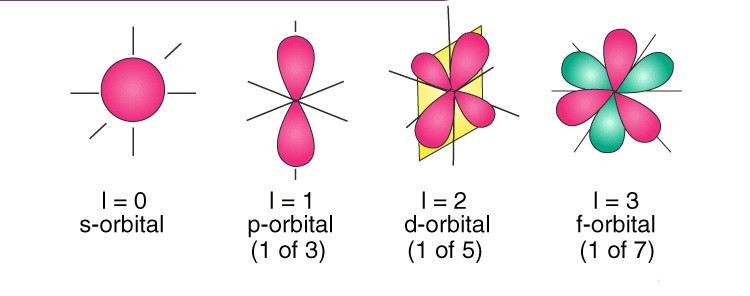
عدد کوانتومی فرعی (لایه های فرعی) شکل اوربیتال را نمایش می دهد. هر لایه اصلی با عدد کوانتومی n می تواند n-1 تا اوربیتال فرعی داشته باشد. عدد کوانتومی فرعی عددهای L=0,1,2, … , n-1 می تواند باشد. L=0 مربوط به اوربیتال s می باشد که کروی شکل می باشد و فقط به یک حالت در فضا قرار می گیرد. L=1 مربوط به اوربیتال d می باشد که می تواند در راستاهای مختلفی جهت گیری کند (x,y,z). در اینجاست که عدد کوانتومی دیگری به نام عدد کوانتومی مغناطیسی تعریف می شود.
عدد کوانتومی مغناطیسی (m)
تحت تاثیر میدان مغناطیسی هر تراز فرعی L به ترازهای دیگری شکافته می شود. m جهت گیری اوربیتال در فضا را نشان می دهد و مقدار عددی آن بین –L و +L قرار می گیرد. تراز فرعی S چون کروی شکل است و L=0 دارد، از این میدان متاثر نمی شود و جهت گیری آن در تمام جهات یکسان است. اما اوربیتال P با L=1 و اعداد کوانتومی مغناطیسی ۱+، ۰، ۱-، دارای سه شکل Px, Py, Pz می باشد. همچنین اوربیتال d می تواند شکل های مختلفی در جهات مختلف داشته باشد.
عدد کوانتومی مغناطیسی اسپینی (mS)
الکترون به دور محور خودش می چرخد و حرکت اسپینی دارد. این حرکت در جهت عقربه های ساعت و یا در خلاف جهت عقربه های ساعت است. عدد کوانتومی مغناطیسی اسپینی می تواند ½- و ½+ باشد که جهت چرخش الکترون به دور خود است.
شکل اوربیتالها
هر لایه اصلی با عدد کوانتومی اصلی (n) تعدادn-1 تا اوربیتال دارد.
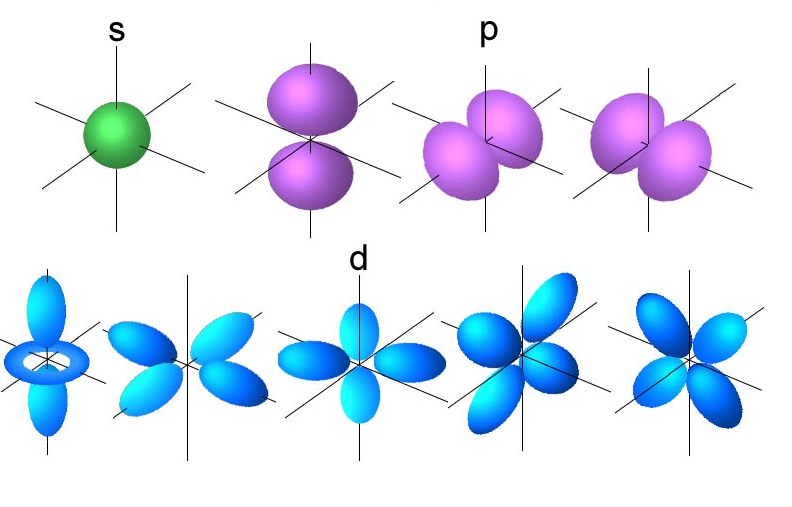
اوربیتال S :
در n=1 که L=0 است فقط یک اوربیتال کروی و تک لپی ۱S وجود دارد. در این اوربیتال m=0 است. اوربیتالهای S فقط می تواند دو الکترون در خود جای دهد. در لایه های بعدی نیز اوربیتالهای ۲S, 3S, 4S,… هستند که در مقایسه با اوربیتال ۱S بزرگتر هستند.
اوربیتال P :
در لایه n=2 دو اوربیتال کروی ۲S و دمبلی ۲P وجود دارد. اوربیتال P از دو اوربیتال کروی تغییر شکل یافته که به شکل دمبلی و در راستای سه جهت محورهای مختصات (x,y,z) قرار گرفته، تشکیل شده است. اوربیتالهای Px, Py, Py از لحاظ انرژی برابرند. اگر این اوربیتالها تحت تاثیر میدان مغناطیسی نباشند بین الکترون های این اوربیتالها نمی توان تفاوتی قایل شد. در این لایه m=-1,0,+1 است. هر کدام از حالت های اوربیتالهای P فقط می توانند دو الکترون بپذیرند که سر جمع اگر در سه ضرب شود، ۶ الکترون در اوربیتال P جای می گیرد.
اوربیتال d :
این اوربیتال دارای شکل های مختلفی است. اوربیتال d تعداد ۵ اوربیتال فرعی که از لحاظ انرژی در یک تراز ولی از لحاظ جهت گیری در فضا متفاوت هستند، دارد. این اوربیتالها عبارتند از : dZ۲، dX۲–Y۲، dXY، dXZ، dYZ. این شکل اوربیتال در عدد کوانتومی اصلی n=3 شروع می شوند. عدد کوانتومی مغناطیسی در لایه سوم با L=2 برابر است با : ms=-۲,-۱,۰,+۱,+۲ .
در این حالت های اوربیتال نیز اگر دو الکترون قرار گیرد، در کل ۱۰ الکترون می تواند در اوربیتال d قرار گیرد.
آرایش الکترونی
در چینش الکترون ها در اوربیتالها قوانین زیادی وجود دارد.
اصل طرد پائولی
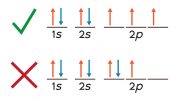
یکی از این قوانین مهم اصل طرد پائولی می باشد که بر طبق آن دو الکترون در یک اتم نمی توانند اعداد کوانتومی یکسان داشته باشند. یعنی نمی توانیم در یک اتم دو الکترون دقیقا یکسانی داشته باشیم. پس طبق این اصل درهر اوربیتال حداکثر دو الکترون آن هم با اسپین های مختلف جای می گیرد. که الکترون ها داخل اوربیتال با علامت فلش رو به بالا (اسپین مثبت) و فلش رو به پایین (اسپین منفی) نشان داده می شود.
قاعده هوند
یکی دیگر از این قوانین قاعده هوند است که بر طبق آن اوربیتالها با سطح انرژی یکسان هم تراز بوده و پایدارترین آرایش الکترونی زمانی است که همه اوربیتالهای هم تراز با تعداد الکترون هایی با جهت یکسان اول پر شود.
اصل آفبا
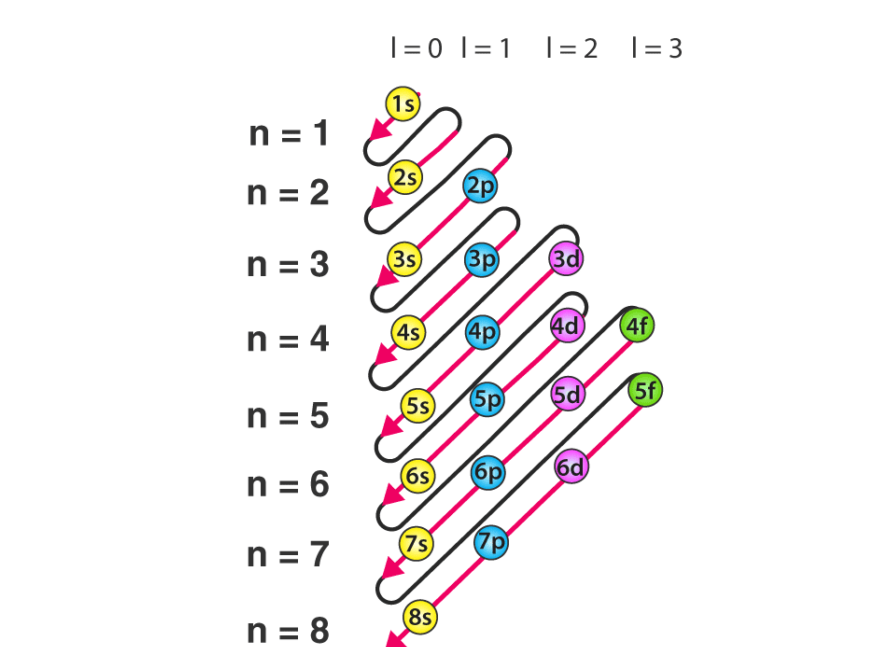
الکترون ها با رعایت نظم و قانون مشخصی که به اصل آفبا مشهور است و توسط بور و پائولی مطرح شد، اوربیتالها را پر می کنند. ابتدا اوربیتال هایی که از نظر انرژی در سطح پایین تری هستند پر می شوند. هم لایه های اصلی و هم اوربیتالها در هر لایه اصلی (زیرلایه ها) نیز از کمترین سطح انرژی به بالاترین سطح انرژی پر می شوند. لایه n=1 اول بعد به ترتیب لایه دوم، سوم و… به ترتیب پر می شوند. در مورد ترتیب پر شدن زیرلایه ها نیز به طور مثال در لایه دوم، از دو اوربیتال S و P، اول S چون سطح انرژی کمتری دارد و سپس اوربیتال P پر می شد.
ترتیب پرشدن از فرمول n+L پیروی می کند. مثلا ۴S زودتر از ۳d پر می شود. چون طبق فرمول n+L اولی ۴ و برای ۳d برابر ۵ است. هر اوربیتال تعداد ۲(۲L+1) الکترون می تواند در خود جای دهد. مثلا اوربیتال P با این فرمول حداکثر ۶ الکترون و اوربیتال d، ۱۰ الکترون و اوربیتال f، ۱۴ الکترون می تواند در خود جای می دهد.
ترتیب پر شدن اوربیتال ها توسط الکترون ها طبق ترتیب زیر انجام می شود.
رسم آرایش الکترونی عناصر
برای رسم آرایش الکترونی از سمت چپ اول شماره لایه اصلی نوشته می شود. بعد حرف زیر لایه و در انتها بالای حرف نوشته شده الکترون آن نوشته می شود. در روش دیگر آرایش الکترونی را به شکل مربع نشان داده و الکترون ها را داخل آن همان طور که قبلا اشاره شده با فلش هایی با اسپین مخالف نشان می دهند.
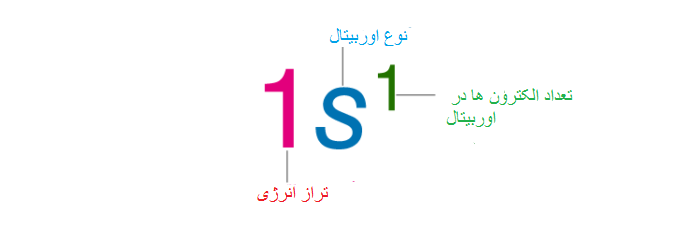
در اینجا آرایش الکترونی سدیم با عدد اتمی ۱۱ را می نویسیم.
Na : 1S۲ ۲S۲ ۲P۶ ۳S۱
نکته :
در نوشتن آرایش الکترونی روشی به اسم خلاصه نویسی داریم. آرایش الکترونی را به صورت ترکیب آرایش الکترونی گاز نجیب ما قبل عنصر مربوطه می نویسیم و سپس آرایش الکترونی الکترون های باقی مانده را اضافه می کنیم. با این تعریف آرایش الکترونی سدیم ۱۱ با استفاده از آرایش الکترونی گاز نجیب نئون ۱۰ به شکل زیر نوشته می شود.
Na : [۱۰Ne] 3S۱
اوربیتال چیست به زبان ساده
اوربیتالهای اتمی مکانهایی هستند که هسته اتم را احاطه کردهاند که احتمال وجود الکترونها در هر زمان معین وجود دارد. این یک تابع ریاضی است که رفتار موج مانند یک الکترون یا یک جفت الکترون در یک اتم را توصیف می کند.
کلمه “اوربیتال” به این دلیل به کار می رود که تصور می شد الکترون ها مشابه منظومه شمسی رفتار می کنند، جایی که هسته مانند خورشید است و الکترون ها مانند سیارات در مدار هستند. تعداد اوربیتال های اتمی در یک عنصر با دوره ای که عنصر در آن قرار دارد تعریف می شود. الکترون ها بسته به سرعت حرکت آنها و تعداد الکترون های دیگر بین اوربیتال ها حرکت می کنند.
در نظریه اتمی و مکانیک کوانتومی، اوربیتال اتمی یک عدد کوانتومی است. هر اوربیتالی می تواند توسط یک یا دو الکترون اشغال شود. نحوه چیدمان اوربیتال ها به آرایش الکترونی اتم ها مربوط می شود. با درک اوربیتال های اتمی، دانشمندان می توانند انواع پیوندهای شیمیایی که بین اتم ها ایجاد می شود را توضیح دهند. این پیوندها مسئول تشکیل مولکول ها و تنوع ماده هستند.
اوربیتال های اتمی نقش مهمی در تعیین خواص و واکنش پذیری عناصر دارند و راه را برای اکتشافات پیشگامانه در شیمی و فیزیک کوانتومی هموار می کنند. چه تجسم ابر الکترونی یا درک اسپین الکترون، مطالعه اوربیتال های اتمی همچنان دانشمندان را مجذوب خود می کند و درک ما را از اجزای سازنده اساسی جهان عمیق تر می کند.
این نواحی جذاب در اطراف هسته چارچوبی برای آرایش الکترون ها فراهم می کند. از طریق مطالعه اوربیتال های اتمی، دانشمندان توانسته اند جزئیات پیچیده ساختار اتمی و جدول تناوبی را کشف کنند. از شکل ها و جهت گیریهای مختلف اوربیتالها تا اصول حاکم بر پر شدن آنها، اوربیتالهای اتمی کمک قابل توجهی به درک ما از شیمی و فیزیک کرده است.