بررسی واکنش برگشت پذیر و مقایسه آن با واکنش تعادلی

واکنش برگشت پذیر یکی از انواع واکنش های شیمیایی هستند که در آن پس از تبدیل واکنش دهنده ها به محصولات فراورده، فراورده ها نیز می توانند با یکدیگر واکنش داده و واکنش دهنده ها را تولید کنند.
واکنش های برگشت ناپذیر و تعادلی از دیگر واکنش های شیمیایی هستند. در این مقاله از نشریه علمی جهان شیمی به بررسی واکنش های برگشت پذیر، برگشت ناپذیر و تعادلی می پردازیم.
انواع واکنش های شیمیایی
واکنش های شیمیایی از لحاظ سینتیکی به دو دسته کلی واکنش های برگشت پذیر و برگشت ناپذیر تقسیم می شوند.
واكنش برگشت پذير
واکنش برگشتپذیر که به انگلیسی به آن Reversible reaction گفته می شود واکنشی است که در آن واكنش دهنده ها به فراورده تبديل و در عين حال فراورده ها نيز به واكنش دهنده ها تبديل شوند. به عنوان مثال در واکنش a A + b B ↽ − − ⇀ c C + d D ، واکنش A و B باعث تشکیل C و D می شود. در واکنش برگشت پذیر،C و D با یکدیگر واکنش داده A و B را تشکیل می دهند.
مثال هايی از واکنش برگشت پذير
- چرخه آب در طبيعت مثالی از فرايندهای برگشت پذير فيزيكی است.
- تبديل نمک های آبدار یا متبلور و نمک های بی آب به يكديگر از طریق گرما دادن و یا افزودن مجدد آب به آن ها نمونه هایی از واکنش های برگشت پذیر هستند.
- حل شدن سنگ های آهكی در آب های زير زمينی و رسوب مجدد اين سنگ ها به صورت لايه های آهک در غارها که استالاگتيت و استالاگميت نامیده می شوند در این گروه جای دارد.
- اسیدها و بازهای ضعیف مانند کربنیک اسید، واکنش های برگشت پذیر انجام می دهند.
H۲CO۳ (l) + H۲O(l) ⇌ HCO−۳ (aq) + H۳O+(aq)
تاریخچه معرفی واکنش برگشت پذیر
اولین بار برتوله در سال ۱۸۰۳ مفهوم واکنش برگشت پذیر را تعریف کرد. او تشکیل بلور های کربنات سدیم در لبه ی دریاچه ی شور یکی از دریاچه های ناترونی مصر در سنگ آهک را مشاهده کرد.
۲NaCl + CaCO۳ → Na۲CO۳ + CaCl۲
برتوله این واکنش را به عنوان عکس واکنش آشنای زیر تایید کرد.
Na۲CO۳ + CaCl۲→ ۲NaCl + CaCO۳
تا آن زمان، تصور بر این بود که واکنش های شیمیایی همواره در یک جهت پیش می روند. برتوله چنین استدلال کرد که نمک اضافی درون دریاچه، تعادل را به سوی واکنش برگشتی سوق می دهد.
در سال ۱۸۶۴ واگ و گلدبرگ قانون واکنش جرمی خود را منتشر کردند. قانون واکنش جرمی، مشاهده ی برتوله را کمی سازی کرد. بین سال های ۱۸۸۴ و ۱۸۸۸، لوشاتلیه و براون اصل لوشاتلیه را ارائه کردند. این اصل، همان ایده را با توصیفی عمومی تر درباره ی اثرات عوامل مختلف به جز غلظت در وضعیت تعادل، بسط داد.
واكنش های برگشت ناپذير
واكنش های برگشت ناپذير واكنش هايی هستند كه با انجام آن ها تمام واكنش دهنده ها به فراورده تبديل می شوند. در ادامه به برخی از واكنش های برگشت ناپذير كه به طور كامل انجام می شوند اشاره می کنیم.
واكنش های سوختن
چون واكنش هاي سوختن با آزاد شدن انرژي همراه هستند، با انجام آنها سطح انرژي فراورده ها كاهش مي يابد و اين واكنش ها فقط در جهت رفت انجام پذيرند.
واكنش های اسيد و باز
در این واکنش ها اسید و باز با یکدیگر واکنش داده، نمک و آب تولید می کنند.
آب + نمك → اسيد + باز
M(OH)n(aq) + HmA(aq) → MmAn(aq) + nH۲O(l)
۲KOH(aq) + H۲SO۴(aq) → K۲SO۴ + ۲H۲O(l)
برخی واکنش های انجام شده در سامانه باز
واكنش هايی كه در سامانه باز انجام شده و با انجام آن ها فراورده ای به صورت گاز توليد می شود از نوع برگشت ناپذیر هستند.
CaCO۳(s) → CaO(s) + CO۲(g)
Na۲SO۳(s) + 2HCl(aq) → ۲NaCl(aq) + SO۲(g) + H۲O(l)
واكنش های رسوبی
واكنش های رسوبی واكنش هايی هستند كه در آن ها فراورده ای به صورت تركيبی نامحلول توليد می شود.
Pb(NO۳)۲(aq) + K۲CrO۴(aq) → PbCrO۴(s) + 2KNO۳(aq)
FeCl۳(aq) + 3NaOH(aq) → Fe(OH)۳(s) + 3NaCl(aq)
واكنش های اكسايش-كاهش
واكنش های اكسايش-كاهش، واكنش هايی هستند كه با انتقال الكترون از جسم كاهنده به جسم اكسنده همراه هستند.
Mg(s) + 2AgNO۳(aq) → Mg(NO۳)۲(aq) + 2Ag(s)
Cl۲(g) + 2KI(aq) → I2(l) + 2KCl(aq)
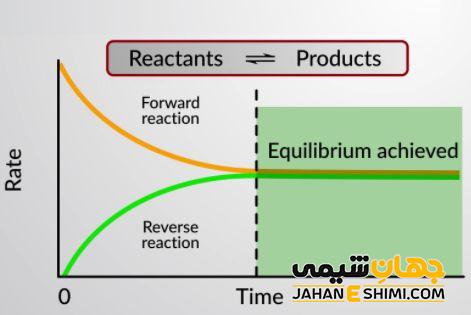
واكنش تعادلی چیست
چنانچه در يک واكنش برگشت پذير، هر دو واكنش رفت و برگشت به طور همزمان و با سرعت های برابر انجام شوند، غلظت ها به مقدار ثابتی می رسند. به طوری که حتی با گذشت زمان، تمایل به تغییر وجود ندارند. هنگامی که غلظت واکنش دهنده ها و فراورده ها با زمان تغییر نکند تعادل شیمیایی حاصل می شود. چنین واکنشی واکنش شیمیایی نامیده می شود.
ویژگی های سیستم در حال تعادل
- سرعت واکنش رفت با سرعت واکنش برگشت برابر است.
- سیستم بسته بوده و هیچ گونه مبادله جرمی با محیط ندارد.
- غلظت، رنگ و دیگر خواص ماکروسکوپی بدون تغییر باقی می ماند.
- در حالت میکروسکوپی سیستم پویا است و واکنش رفت و برگشت در سطح مولکولی به طور دائم انجام می شود.
انواع واکنش های تعادلی
به طور کلی دو نوع واکنش تعادلی همگن (هموژن) و ناهمگن (هتروژن) وجود دارد.
واکنش تعادلی همگن
در تعادل همگن واکنش دهنده ها و محصولات در یک فاز بوده و تعداد مولکول های واکنش دهنده و فراورده می توانند باهم برابر و یا متفاوت باشند.
H۲ (g) + I۲ (g) ⇌ ۲HI (g)
۲SO۲ (g) + O۲ (g) ⇌ ۲SO۳ (g)
واکنش تعادلی ناهمگن
در تعادل ناهمگن واکنش دهنده ها و محصولات در فازهای متفاوتی دیده می شوند.
CaCO۳ (s) ⇌ CaO (s) + CO۲ (g)
ثابت تعادل شیمیایی چیست
Keq پارامتری بدون واحد است که بر اساس غلظت تعادلی واکنش دهنده ها و فراورده ها تعریف می شود. این ثابت به عواملی نظیر دما و فشار بستگی دارد.
بررسی عوامل موثر بر تعادل شیمیایی
تغییر غلظت، دما، فشار و افزودن کاتالیست از جمله عواملی هستند که می توانند تعادل شیمیایی را دستخوش تغییر کنند. بر اساس اصل لوشاتلیه، هرگاه تغییری در تعادل فیزیکی و شیمیایی ایجاد شود، سیستم در جهت خنثی کردن یا کاهش این اثر و بازگشت به شرایط اولیه عمل می کند.
تغییر غلظت
در اثر تغییر غلظت، ترکیب مخلوط در تعادل تغییر می کند. در صورتی که به غلظت یکی از اجزا اضافه شود واکنش در جهتی پیش می رود که آن را مصرف کند. اگر از مقدار و غلظت ماده ای کاسته شود واکنش در جهت تولید و جایگزینی آن جابجا می شود.
تغییر فشار
دلیل تغییر فشار تغییر حجم است. این امر می تواند بر تعداد مول های واکنش دهنده ها و فراورده های گازی تاثیر بگذارد. در حالت هتروژن یا ناهمگن، از تاثیر فشار بر مواد مایع و جامد صرف نظر می شود، زیرا حجم آن ها مستقل از فشار است.
تغییر دما
تاثیر تغییر دما بر تعادل شیمیایی به علامت ΔH بستگی دارد.ΔH واکنش های گرمازا منفی است. از این رو، با افزایش دما تعادل به سمت واکنش دهنده پیش رفته و ثابت تعادل آن ها کاهش می یابد. این در حالی است که ΔH واکنش های گرماگیر مثبت است. به این ترتیب، با افزایش دما تعادل به سمت محصول پیش رفته و ثابت تعادل افزایش می یابد.
اثر کاتالیزور
کاتالیزور بر تعادل شیمیایی تاثیری نداشته و تنها سرعت واکنش رفت و برگشت را به یک میزان تحت تاثیر قرار می دهد. به عبارتی دیگر، افزودن کاتالیزور تنها موجب افزایش سرعت به تعادل رسیدن واکنش می شود. این امر سبب می شود واکنش با انرژی کمتری به انجام برسد.
تعادل شیمیایی چه اهمیتی در صنعت دارد
تعادل شیمایی در تولید آمونیاک و سولفوریک اسید، در مقیاس صنعتی عاملی تاثیر گذار است که در ادامه به آن می پردازیم.
تهیه آمونیاک
در فرایند هابر در اثر اختلاط هیدروژن و نیتروژن، آمونیاک تشکیل می شود. واکنش تعادلی موجود در دمای پایین، فشار بالا و استفاده از کاتالیزور آهن سبب می شود بازده بهتری داشته و آمونیاک بیشتری تولید کند.
N۲(g)+3H۲(g)⇌۲NH۳(g) ΔH=−۹۲.۴kJ/mol
تولید سولفوریک اسید
یکی از عمده ترین روش های تولید این اسید فرایند مجاورت است. اساس این فرایند اکسیداسیون دی اکسید گوگرد به تری اکسید گوگرد است که طی واکنش تعادل شیمیایی صورت می گیرد.
مقایسه واکنش تعادلی و واکنش برگشت پذیر
در واکنش های تعادلی با وجود این که سرعت واکنش رفت و برگشت برابر است ولی الزاما انرژی فعالسازی رفت و برگشت برابر نمی شود. در برخی از تعادل های خاص ممکن است انرژی فعالسازی رفت و برگشت برابر باشد.
هر واکنشی که گرماده یا گرماگیر باشد حتما انرژی فعالسازی دو مسیر رفت و برگشت آن متفاوت خواهد بود. به نظر می رسد همه ی واکنش ها با مبادله ی گرما همراه هستند. سرعت واکنش های تعادلی در ابتدا یکسان نیست. اما هنگامی که تعادل برقرار می شود سرعت ها برابر می شوند.
از جمله ی این واکنش ها می توان واکنش استری شدن را مثال زد. تقریبا واکنش استری شدن بی گرماده است. در لحظه تعادل چه واکنش گرماده باشد و چه گرماگیر، سرعت رفت و برگشت آن دقیقا برابر است. هیچ واکنش تعادلی در آغاز واکنش برگشت ندارد.
به عنوان مثال، یک بطری در بسته که تا نیمه آب دارد، سرعت تبخیر و میعان در آن برابر است. واکنش تبخیر گرماگیر است. زیرا، در واکنش جابجایی پیوند اتفاق می افتد و انرژی پیوندها برابر نیست. به همین دلیل، احتمال این که مجموع آن ها کاملا صفر باشد وجود ندارد.

دیگر ویژگی های واکنش تعادلی و واکنش برگشت پذیر
همه ی واکنش های برگشت پذیر می توانند به تعادل برسند. فرقی نمی کند گرماگیر باشند یا گرماده. در همه ی واکنش های تعادلی، انرژی فعالسازی رفت و برگشت متفاوت است. این در حالی است که سرعت آن ها می تواند برابر باشد.
زیرا سرعت فقط تابع گرما نیست و به غلظت هم بستگی دارد. برابری انرژی های فعالسازی، شرط لازم برای برابری سرعت ها نیست. در ابتدای واکنش سرعت رفت زیاد است اما با گذشت زمان به علت کاهش غلظت واکنش دهنده ها کم می شود. به علت افزایش غلظت فراورده ها، به سرعت برگشت افزوده می شود. هنگامی که سرعت واکنش رفت و برگشت برابر شود تعادل ایجاد می شود.



















