پیوند داتیو (Dative bond) یا پیوند کئوردینانس نوعی پیوند کووالانسی محسوب می شود که در آن، هر دو الکترون اشتراکی از یک اتم به اوربیتال خالی اتم دیگر وارد می شوند. در واقع اتم دوم تنها در الکترون های اشتراکی اتم اول شریک می شود، بدون آنکه خود الکترونی به اشتراک بگذارد. در این مقاله در نشریه جهان شیمی فیزیک به بررسی پیوند داتیو پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۲- پیوند داتیو شیمی دهم
۱-۲- شرط تشکیل پیوند داتیو
۲-۲- تفاوت پیوند کوالانسی معمولی و پیوند داتیو
۳-۲- قطبیت پیوند کئوردینانس
۳- عناصر گروه های مختلف و تشکیل پیوند کئوردینانس
۱-۳- گروه های دهنده داتیو (دهنده جفت الکترون آزاد)
۲-۳- گروه های گیرنده داتیو (گیرنده جفت الکترون آزاد)
۳-۳- گروه هایی که پیوند داتیو نمی دهند
۴- تعیین تعداد پیوند کئوردینانس در یک مولکول
۵- نکات مهم در تشخیص گروه ها و پیوند داتیو در ترکیبات شیمی کنکور
۶- مثال هایی از پیوند کئوردینانس
۱-۶- پیوند کئوردینانس پروتون با آمونیاک و تشکیل یون آمونیوم
۲-۶- پیوند کئوردینانس پروتون با آب و تشکیل یون هیدرونیوم
۳-۶- پیوند کئوردینانس بین مولکول های آمونیاک و بور تری فلوئورید
۴-۶- پیوند کئوردینانس در منوکسید کربن
۵-۶- پیوند کئوردینانس در اسید نیتریک
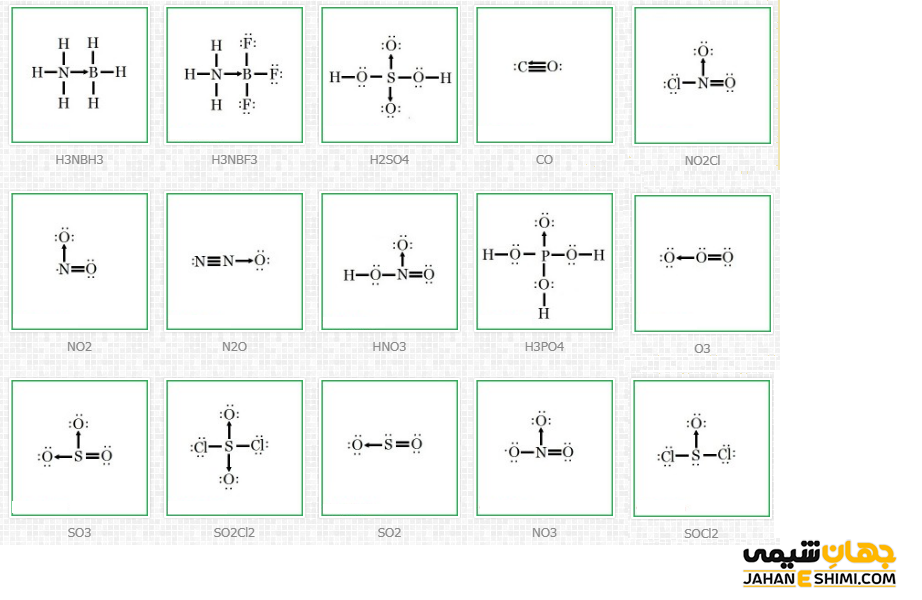
۷- ساختار لوویس ترکیبات دارای پیوند داتیو
مقدمه
همان طور که می دانید، پیوند کووالانسی (یا پیوند اشتراکی) نوعی پیوند شیمیایی محسوب می شود که دو نوع مختلف دارد. اولین نوع، پیوند کوالانسی معمولی است که در این نوع پیوند در حقیقت دو اتم شرکت کننده در پیوند کووالانسی هر کدام به تعداد مساوی الکترون در پیوند به اشتراک می گذارند. در این حالت نمی توان تشخیص داد که الکترون های اشتراکی متعلق به کدام اتم می باشند. مانند پیوند میان اتم های زیر :
A. + .B یا A : B
دومین نوع، پیوند داتیو است که در این نوع پیوند یک اتم جفت الکترون اشتراکی را وسط می گذارد و اتم دیگر در حقیقت با داشتن اوربیتال خالی، لایه ظرفیت جفت الکترون پیوندی را می پذیرد. همانند پیوند میان اتم های زیر :
A: + B یا A : B
پیوند داتیو شیمی دهم
در پیوند داتیو، یک اتم دو الکترون پیوندی را تامین می کند، در حالیکه اتم دیگر که در واقع الکترون کم دارد، الکترونی را برای پیوند تامین نمی کند و این دو الکترون اشتراکی اتم اول را می پذیرد. به بیان دیگر، پیوند داتیو به پیوندی گفته می شود که در آن، یک اتم هر دو الکترون لایه والانس خود را به اشتراک بگذارد. در این نوع پیوند، به اتمی که الکترون های پیوندی را فراهم می کند، دهنده الکترون و به اتم دیگر، پذیرنده الکترون می گویند. پیوند کئوردینانس را می توان به شکل یک فلش (پیکان) از سمت اتم دهنده الکترون به طرف اتم گیرنده الکترون نشان داد. این پیوند در بسیاری از ترکیبات شیمی معدنی نظیر ترکیبات کمپلکس وجود دارد.
شرط تشکیل پیوند داتیو
پیوند داتیو در حالتی تشکیل می شود که اتمی که الکترون ها را در پیوند به اشتراک می گذارد، باید در لایه الکترونی (لایه والانس یا ظرفیت) خود، حداقل یک جفت الکترون غیر پیوندی داشته باشد. به عنوان مثال می توان به اتم اکسیژن با دو جفت الکترون ناپیوندی و اتم نیتروژن با یک جفت الکترون ناپیوندی اشاره کرد. علاوه بر آن، اتم دیگر نیز بایستی حداقل دارای یک اوربیتال خالی در لایه ظرفیت خود باشد مانند اتم های بور و آلومینیوم.
تفاوت پیوند کوالانسی معمولی و پیوند داتیو
پیوند کوالانسی معمولی و پیوند کئوردینانس تنها در ماهیت تشکیل خود با یکدیگر متفاوت می باشند. چنانچه پیوند ها مشابه یکدیگر باشند (مانند یون آمونیوم)، بنابراین بعد از تشکیل پیوند، هیچ تفاوتی بین آنها از لحاظ طول پیوند و یا انرژی پیوند وجود ندارد. در واقع بعد از تشکیل پیوند ها، نمی توان گفت کدام یک از پیوند ها، داتیو بوده است. مثلا یون آمونیوم را در نظر بگیرید. با وجود آنکه الکترون ها را در تصویر یون به شکل متفاوتی نشان می دهند، اما در واقعیت، هیچ تفاوتی بین این پیوند ها وجود نخواهد داشت.
قطبیت پیوند کئوردینانس
از آنجاییکه دو الکترون اشتراکی بین اتم های درگیر در پیوند داتیو از یک اتم می باشند، بنابراین قطبیت پیوند تشکیل شده بیشتر از سایر پیوند های کووالانسی است که در آنها یک الکترون از هر اتم در پیوند شرکت می کند. توجه داشته باشید اتم های دهنده الکترون و گیرنده الکترون بعد از تشکیل پیوند کئوردینانس، به صورت کاتیون و یا آنیون در نمی آیند. پس پیوند داتیو یک پیوند یونی نخواهد بود. اما به طور کلی می توان مولکول تشکیل شده را به عنوان کاتیون در نظر گرفت.
عناصر گروه های مختلف و تشکیل پیوند کئوردینانس
گروه های دهنده داتیو (دهنده جفت الکترون آزاد)
- ترکیباتی که اتم مرکزی آنها به گروه های ۱۵ تا ۱۸ جدول تناوبی متعلق باشد، درصورتیکه که اتم مرکزی آنها بالاترین ظرفیت خود را نداشته باشد، دهنده داتیو خواهند بود. توجه داشته باشید که بالاترین ظرفیت اتم هر عنصر برابر با شماره گروه آن عنصر خواهد بود.
- یون های منفی نیز به دلیل داشتن بار منفی، جفت الکترون آزاد در لایه والانس خود دارند، پس می توانند دهنده داتیو باشند. همچون یون هیدرید و کلرید.
گروه های گیرنده داتیو (گیرنده جفت الکترون آزاد)
- ترکیباتی که اتم مرکزی آنها به گروه های دو (فلزات قلیایی خاکی) و ۱۳ (بور و آلومینیوم … ) متعلق باشد، گیرنده داتیو خواهند بود. مانند مولکول های BCl۳، BeCl۲ و AlF۳.
- یون های مثبت نیز به دلیل از دست دادن الکترون، اوربیتال خالی در لایه والانس خود دارند، پس می توانند گیرنده داتیو باشند. همچون یون های +H.
گروه هایی که پیوند داتیو نمی دهند
- عناصر گروه یک اصلی، پیوند کوالانسی تشکیل نمی دهد، پس در تشکیل پیوند داتیو نیز شرکت نمی کنند.
- عناصر گروه ۱۴ نیز اوربیتال خالی یا جفت الکترون آزاد ندارد. بنابراین نه به عنوان دهنده الکترون و نه گیرنده الکترون در پیوند داتیو شرکت نخواهند کرد.
- اگر اتم مرکزی به گروه های ۱۵، ۱۶، ۱۷ یا ۱۸ جدول تناوبی متعلق باشد و بالاترین ظرفیت خود را داشته باشد، از این رو جفت الکترون آزاد نداشته و در نتیجه پیوند داتیو نمی دهد.
تعیین تعداد پیوند کئوردینانس در یک مولکول
جهت تعیین تعداد پیوند های کئوردینانس در ترکیبات اکسیژن دار گروه های ۱۵ تا ۱۸ جدول تناوبی می توان از فرمول زیر استفاده کرد. فقط توجه داشته باشید که ترکیبات H۳PO۳ و H۳PO۲ تنها یک پیوند داتیو دارند و در نتیجه به فرمول فوق جواب نمی دهند.
۲ / (ظرفیت معمولی اتم مرکزی – ظرفیت اتم مرکزی در ترکیب) = تعداد پیوند های کئوردینانس
به عنوان مثال در مولکول HClO۳ دو پیوند داتیو وجود دارد (۲ / (۱ – ۵)). مولکول های NO۲ و N۲O۴ نیز به ترتیب یک و دو پیوند داتیو دارند.
نکات مهم در تشخیص گروه ها و پیوند داتیو در ترکیبات شیمی کنکور
- گروه های دهنده داتیو بایستی جفت الکترون آزاد داشته باشند، در حالیکه گروه های گیرنده داتیو اوربیتال خالی دارند.
- ظرفیت اصلی اتم مرکزی را در نظر بگیرید. اتمی که الکترون های والانس کمتری نسبت به حالت عادی دارد، دهنده داتیو و اتمی که الکترون ظرفیت بیشتری نسبت به حالت عادی دارد گیرنده داتیو خواهند بود. به عنوان نمونه، در یون سولفات، اتم گوگرد دارای ۵ الکترون می باشد، پس از ظرفیت اصلی خود یک الکترون کمتر دارد، از این رو داتیو دهنده می باشد. یا مثلا ترکیباتی مانند -BF۴–، BeF۴۲ و +NH۴ را در نظر بگیرید. در این ترکیبات ظرفیت های که از اتم مرکزی آنها می شناسید با ظرفیت موجود در ترکیب مطابقت نمی کنند، بنابراین شما را به وجود پیوند های داتیو و شناسایی آن راهنمایی می کند.
- اگر بار قراردادی اتم ها را مشخص نمایید، معمولا به تعداد بار مثبت ترکیب پیوند داتیو وجود دارد.
- عناصر گروه ۱۵ جدول تناوبی (مانند اتم نیتروژن در آمونیاک)، بعد از تشکیل مولکول و رسیدن به آرایش اکتت، یک جفت الکترون آزاد دارند که می توانند آن را در یک پیوند داتیو به عنوان دهنده الکترون شرکت دهند.
- عناصر گروه ۱۶ جدول تناوبی (مانند اتم گوگرد در اسید سولفوریک)، بعد از تشکیل مولکول و رسیدن به آرایش اکتت، دو جفت الکترون آزاد دارند که می توانند در حداکثر دو پیوند داتیو به عنوان دهنده الکترون شرکت کنند.
- عناصر گروه ۱۷ جدول تناوبی (مانند اتم کلر در اسید پرکلریک)، بعد از تشکیل مولکول و رسیدن به آرایش اکتت، سه جفت الکترون آزاد دارند که می توانند در حداکثر سه پیوند داتیو به عنوان دهنده الکترون شرکت کنند.
مثال هایی از پیوند کئوردینانس
در ادامه مقاله، پیوند های داتیو را در مولکول های مختلف بررسی خواهیم کرد.
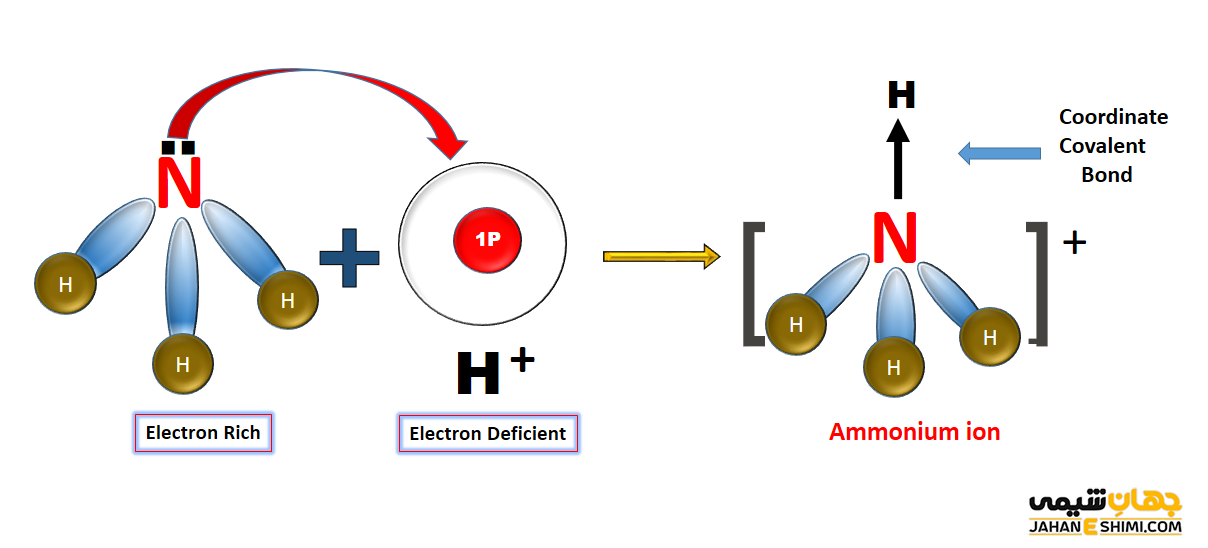
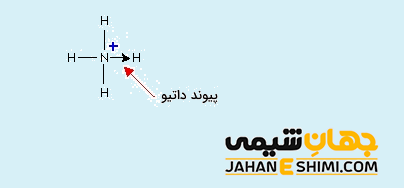
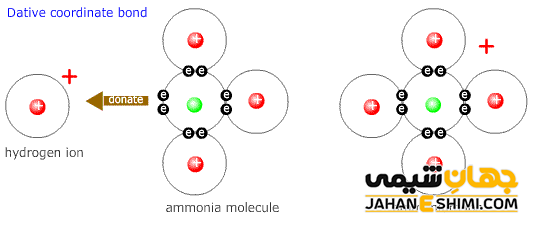
پیوند کئوردینانس پروتون با آمونیاک و تشکیل یون آمونیوم
زمانیکه که گاز هیدروژن در مجاورت گاز آمونیاک قرار گیرد، این دو ماده با یکدیگر واکنش می دهند. در نتیجه مولکول NH۴Cl تشکیل می شود. این مولکول از یون های کلرید (–Cl) و آمونیوم (+NH۴) تشکیل شده است .
در مولکول آمونیاک، اتم مرکزی نیتروژن با سه اتم هیدروژن، پیوند های کووالانسی معمولی N-H تشکیل می دهد. در نتیجه به آرایش الکترونی گاز نجیب دست یافته و یک جفت الکترون آزاد برایش باقی می ماند. اتم نیتروژن می تواند این جفت الکترون آزاد را به شکل داتیو در اختیار اتم هایی که به آن نیاز دارند بگذارد. از طرفی دیگر، اتم هیدروژن که فقط یک الکترون در اوربیتال خود دارد، هر زمان این الکترون تک را از دست بدهد، به یون پروتون تبدیل می شود که اوربیتال آن خالی خواهد بود. حال اگر پروتون به مولکول آمونیاک نزدیک شود، می تواند با آن پیوند داتیو تشکیل دهد و به آرایش گاز نجیب برسد. به این ترکیب یون آمونیوم می گویند که در ترکیباتی همچون هیدروکسید آمونیوم یا کلرید آمونیوم وجود دارد.
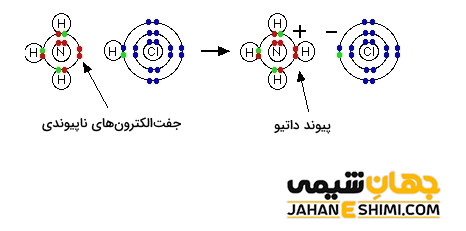
لازم به ذکر است که اندازه گیری ها نشان می دهد که انرژی پیوند و طول پیوند هر چهار پیوند (N-H) در یون آمونیوم کاملا یکسان و مشابه می باشند. در حقیقت پیوند کئوردینانس همانند پیوند کووالانسی معمولی که بین دو هسته اتم های نیتروژن و هیدروژن تشکیل شده است می باشد. در واقع تفاوتی بین این پیوند ها وجود ندارد و نمی توان پیوند داتیو تشکیل شده را از پیوند های کووالانسی معمولی تشکیل شده تشخیص داد.
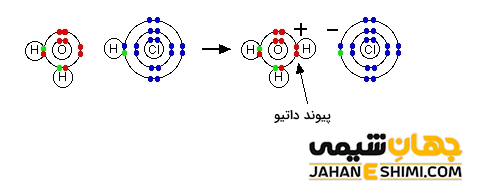
پیوند کئوردینانس پروتون با آب و تشکیل یون هیدرونیوم
زمانیکه اسید کلریدریک در آب حل شود، +H از آن جدا شده و می تواند با مولکول آب پیوند داتیو تشکیل دهد. در واقع اتم اکسیژن مولکول آب دو جفت الکترون غیر پیوندی دارد که می تواند یک جفت الکترون از آنها را در اختیار اوربیتال خالی پروتون بگذارد. بدین صورت کاتیون هیدرونیوم (H۳O+) تشکیل می شود. لازم به ذکر است که با وجود داشتن یک جفت الکترون تنهای دیگر اتم اکسیژن، امکان تشکیل پیوند داتیو دوم وجود ندارد. زیرا کاتیون H+ نمی تواند به کاتیون هیدرونیوم که بار مثبت دارد نزدیک شود.
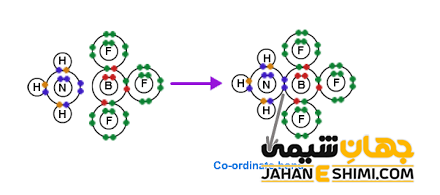
پیوند کئوردینانس بین مولکول های آمونیاک و بور تری فلوئورید
در اینجا، اتم نیتروژن مولکول آمونیاک (NH۳) جفت الکترون غیر پیوندی خود را در اختیار اتم بور مولکول BF۳ که مولکولی فقیر از الکترون است قرار می دهد. به این شکل اتم بور نیز در لایه بیرونی خود دارای هشت الکترون خواهد شد.
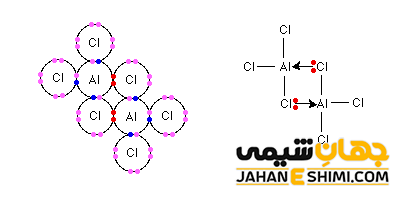
از طرفی دیگر، مولکول آلومینیوم کلرید (AlCl۳) نیز همانند BF۳ فقیر از الکترون است (دارای شش الکترون در لایه والانس)، پس می تواند پیوند کئوردینانس تشکیل دهد. نکته جالب درباره مولکول AlCl۳ اینست که اندازه گیری جرم مولکولی آن در حالت بخار نشان داده است که بایستی به صورت دایمر وجود داشته باشد (Al۲Cl۶). در واقع در این مولکول دو پیوند از طریق داتیو تشکیل شده است .
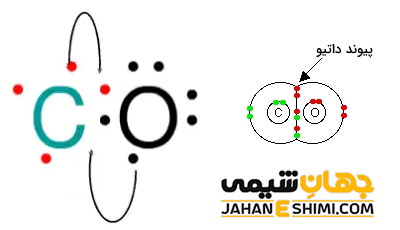
پیوند کئوردینانس در منوکسید کربن
در مولکول منوکسید کربن (CO) دو پیوند کووالانسی بین اتم های کربن و اکسیژن وجود دارد. بدین ترتیب لایه بیرونی کربن دارای شش الکترون می باشد. برای دست یابی به آرایش پایدار گاز نجیب، جفت الکترون آزاد اکسیژن با اتم کربن پیوند کئوردینانس می دهد. در نتیجه ساختار به شکل C ≡ O در می آید.
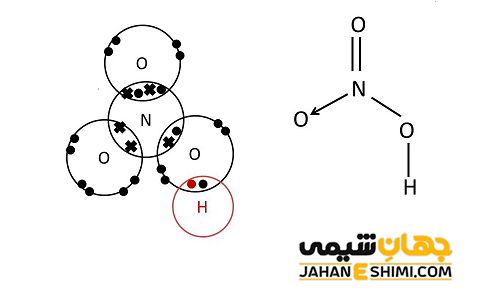
پیوند کئوردینانس در اسید نیتریک
در اغلب اسید های اکسیژن دار، اتم مرکزی ترکیب با اتم اکسیژن پیوند داتیو تشکیل می دهد. به دلیل اثر القایی منفی این اتم اکسیژن، باعث می شود که قدرت اسیدی در این گونه اسید ها افزایش یابد. به عنوان نمونه، در اسید نیتریک (HNO۳) جفت الکترون غیر پیوندی در اتم نیتروژن با یکی از اتم های اکسیژن به وسیله پیوند متصل می شود.
ساختار لوویس ترکیبات دارای پیوند داتیو