در علم شیمی و بلور شناسی، انرژی شبکه (Lattice energy) به تغییرات آنتالپی گفته می شود که در طی آن، یون های مثبت و منفی برای تشکیل بلور و شبکه بلوری متراکم می شوند. به عبارت دیگر، به میزان انرژی آزاد شده در هنگام تشکیل و ایجاد یک مول جامد یونی یا ترکیب یونی از یون های گازی شکل سازنده آن، انرژی شبکه بلور می گویند. این انرژی در واقع معیار مناسبی جهت اندازه گیری قدرت پیوند یونی در ترکیبات یونی می باشد. در مقاله های پیشین نشریه جهان شیمی فیزیک، درباره پیوند های یونی و همچنین ترکیبات یونی توضیحاتی ارائه شده است. در این مقاله به بررسی بیشتری در رابطه با انرژی شبکه و عوامل موثر بر آن پرداخته می شود. لطفا همراهی بفرمایید.
فهرست مطالب این مقاله
۱- انرژی شبکه در ترکیبات یونی
۲- علامت انرژی شبکه
۳- عوامل موثر بر انرژی شبکه
۴- آنتالپي شبكه
۵- تعيين انرژی شبكه بلوری با استفاده از چرخه بورن – هابر
انرژی شبکه در ترکیبات یونی
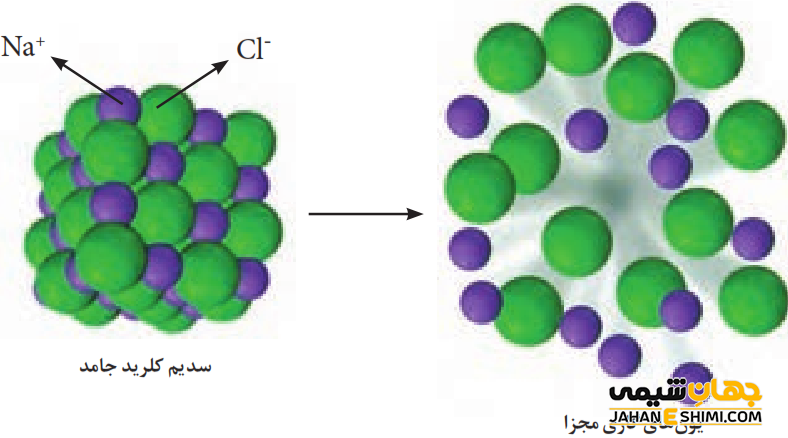
یک ترکیب یونی اغلب از یک فلز به عنوان کاتیون و یک نافلز به عنوان آنیون تشکیل شده است. فلزات برای رسیدن به ساختار پایدار و تکمیل آرایش الکترونی خود (قاعده اکتت)، الکترون از دست می دهند. در حالیکه نافلزات الکترون می گیرند. در نتیجه واکنش بین فلزات با نافلزات (پیوند یونی و جاذبه الکترواستاتیکی بین یون های مثبت و منفی) باعث تشکیل ترکیب یونی می شود. توجه داشته باشید که آرايش يون ها در ساختار بلور، به صورت يک الگوی تکراری می باشد که در سرتاسر بلور تکرار شده است. یون ها در ساختار ترکیب یونی به شکلی در کنار هم قرار گرفته اند که نسبت به یکدیگر، بیشترین جاذبه و کمترین دافعه را داشته باشند.
انرژی شبکه در یک ساختار بلوری در واقع جمع اثر متقابل نیروهای دافعه و جاذبه خواهد بود. به عنوان نمونه واکنش بین سدیم و کلر را در نظر بگیرید. ابتدا مواد سدیم و کلر بایستی به اتم های مربوطه تبدیل شوند. این فرآیند در حقیقت نیازمند به صرف انرژی است. جدا کردن الكترون از اتم های سديم نیز نياز به صرف انرژی دارد، در حالیکه جذب الكترون به وسیله اتم های كلر با آزاد شدن انرژی همراه می باشد. لازم به ذکر است که این انرژی آزاد شده می تواند بخشی از انرژی صرف شده به وسیله اتم های سدیم را جبران كند. بدین صورت یون های سدیم و کلر تشکیل شده اند.
جالب است بدانید که
زمانیکه کاتیون های سديم و آنیون های كلر در كنار یکديگر قرار بگیرند، تشكيل بلور NaCl همراه با وجود نیرو های جاذبه (جاذبه الکترواستاتیکی میان يون های غیر همنام کلر و سدیم) و همچنین نیرو های دافعه (مثلا نیروهای دافعه ابرهای الكتريكی آنیون ها با یکدیگر و یا نیروهای دافعه بار مثبت کاتیون ها نسبت به یکدیگر) خواهد بود. دقت کنید که نيروی جاذبه تنها محدود به يک عدد کاتيون و یا يک عدد آنيون نمی باشد. این نیرو در حقیقت در تمامی جهات و در ميان تمام يون های غیر همنام مجاور و یا حتی در فواصل مختلف وجود دارد. به همین دلیل است که تعداد بسيار زيادی از کاتیون ها و آنیون ها به سمت يکديگر جذب می شوند و آرايش منظم بوجود می آید.
در ترکیبات یونی نیروهای جاذبه از نیروهای دافعه تاثیر بیشتری می گذارند. از این رو، تشكيل بلور NaCl همراه با كاهش سطح انرژی پتانسيل و در واقع با افزايش پايداری همراه است. توجه داشته باشید که كاهش سطح انرژی پتانسيل و مقدار انرژی آزاد شده به حدی زياد خواهد بود كه انرژی مصرف شده در مراحل قبل را هم می تواند جبران كند.
علامت انرژی شبکه
انرژی شبکه معمولا به دو صورت تعریف می شود. در تعریف اول، انرژی شبکه به مقدار انرژی آزاد شده در هنگام برهمکنش میان یون های گازی شکل برای تشکیل یک جامد گازی گفته می شود. در این تعریف، فرآیند قطعا گرمازا خواهد بود، پس، علامت انرژی شبکه منفی می باشد. اما در تعریف دوم و در فرآیندی معکوس، انرژی شبکه در واقع انرژی مورد نیاز جهت شکستن یک جامد یونی و تبدیل آن به یون های گازی شکل است. بر طبق این تعریف، مقدار انرژی شبکه همواره عددی مثبت می باشد زیرا اینچنین فرآیندی، گرماگیر خواهد بود. به طور کلی می توان گفت که معمولا انرژی شبکه با علامت منفی گزارش می شود.
عوامل موثر بر انرژی شبکه
انرژی شبکه را می توان به عنوان معیاری مناسب جهت اندازه گیری قدرت پیوند یونی در نظر گرفت. در واقع این انرژی در ترکیبات یونی با تغییر قدرت پیوند های یونی تغییر خواهد کرد. از جمله عوامل موثر بر انرژی شبکه می توان به بار یون ها، شعاع آنها و نوع شبکه اشاره کرد. در حقیقت انرژی شبکه با بار یون ها رابطه مستقیم و با شعاع آنها رابطه ای معکوس دارد. حال اگر دو ترکیب دارای یون هایی با بار مشابه و مساوی باشند، هرچه شعاع یون کمتر باشد، انرژی شبکه بیشتر خواهد بود. بنابراین، هرچه چگالی بار (یعنی نسبت بار به شعاع) بیشتر باشد، انرژی شبکه نیز بیشتر خواهد بود. به عبارت دیگر، هرچه بار یون ها بیشتر و شعاع آنها کوچکتر باشد، پیوند یونی تشکیل شده قوی تر بوده است.
در هنگام تشکیل یک بلور، هرچه قدر مطلق بارهای کاتیون و آنیون بزرگتر باشد، پس به همان نسبت نیز جاذبه الکترواستاتیکی بین آنها قویتر و در نتیجه انرژی آزاد شده نیز بیشتر می باشد. همانطور که بیان شد اندازه یون ها نیز در انرژی شبکه بلور نقش دارد. بدین شکل که هر چه فاصله دو بار غیر همنام از یکدیگر کمتر باشد، نیروی جاذبه میان آنها قویتر بوده و انرژی آزاد شده نیز بیشتر خواهد بود. بنابراین، انرژی شبکه بلور متشکل از یون های کوچکتر که می توانند به هم نزدیکتر شوند، بیشتر از انرژی شبکه بلور متشکل از یون های بزرگتر می باشد. به بیان دیگر، هرچه شعاع یونها کوچکتر باشد، تراکم بار در سطح یون نیز بیشتر می شود. البته به شرط اینکه بار یون های ترکیب یکسان باشد.
جالب است بدانید که
زمانیکه الکترونگاتيويته اتم های درگیر در پیوند یونی، با هم اختلاف بيشتری داشته باشند، پيوند يونی قويتری تشکیل می دهند. زیرا در این صورت جدا کردن یون ها از یکدیگر سخت تر بوده و انرژی ترکیب یونی حاصله بیشتر است. در ادامه برای درک بهتر تاثیر بار و شعاع بر روی انرژی شبکه بلور، مقایسه انرژی چند ترکیب یونی را مشاهده می کنید.
AlF۳ > MgF۲ > NaF
Al۲O۳ > MgF۲
CaO > MgF۲
Fe۲O۳ > FeO > FeCl۲
NaF > KBr
MgO > MgF۲ > Na۲O
LiF > LiI
Al۲O۳ > MgO > Na۲O
به طور کلی هرچه انرژی شبکه بیشتر باشد، قدرت پیوند یونی در آن بیشتر، بنابراین نقطه ذوب و جوش ترکیب نیز بالاتر است. لازم به ذکر است که در برخی موارد استثنا وجود دارد. به عنوان مثال، انرژی شبکه بلور Al۲O۳ بیشتر از بلور MgO است اما نقطه ذوب و جوش آن کمتر از MgO می باشد. در اینجا، پایداری شبکه بلور عاملی محسوب می شود که می تواند این قاعده را نقض کند.
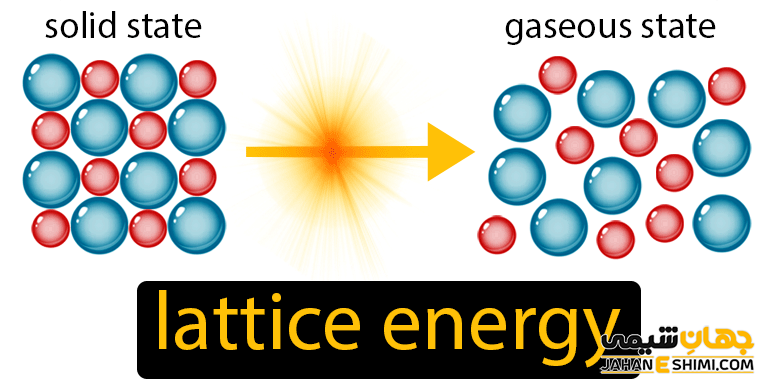
آنتالپی شبكه
همانطور که می دانید، یك شبكه يونی از تعداد زيادی يون های مثبت و منفی تشکیل شده است كه این یون ها با آرايشی منظم در كنار هم چيده شده اند. حال اگر بخواهيد يك شبكه جامد يونی را در هم بريزيد و از آن كاتيون ها و آنيون های گازی شکل و جدا از هم را بدست آوريد، بايستی برای این کار، انرژی مصرف نمایید. به عنوان مثال فرآيند زیر را در نظر بگیرید. در این فرآیند، شبكه يونی كلريد سديم از بين رفته و تبديل به يون های مثبت و منفی سدیم و کلر به حالت گازی شده است که فرآیندی بسيار انرژی گير می باشد.
NaCl (s) → Na+ (g) +Cl− (g)
در واقع به مقدار انرژی لازم جهت انجام اين فرآيند، انرژی شبكه می گویند که با نماد ΔUL نشان داده می شود. به عنوان نمونه، انرژی شبكه كلريد سديم برابر با ۷۸۸ کیلو ژول بر مول می باشد. ارتباط ميان انرژی شبكه (ΔUL) و آنتالپی شبكه (ΔH) با استفاده از معادله عمومی زیر بيان می شود.
ΔH = ΔU + Δn(g) RT
مقدار آنتالپی شبكه جامد یونی كلريد سديم در ۲۵ درجه سانتی گراد، برابر است با :
ΔHL = ΔUL + Δn (g) RT
ΔHL = -۷۸۸ + ۲RT = -411 kJ
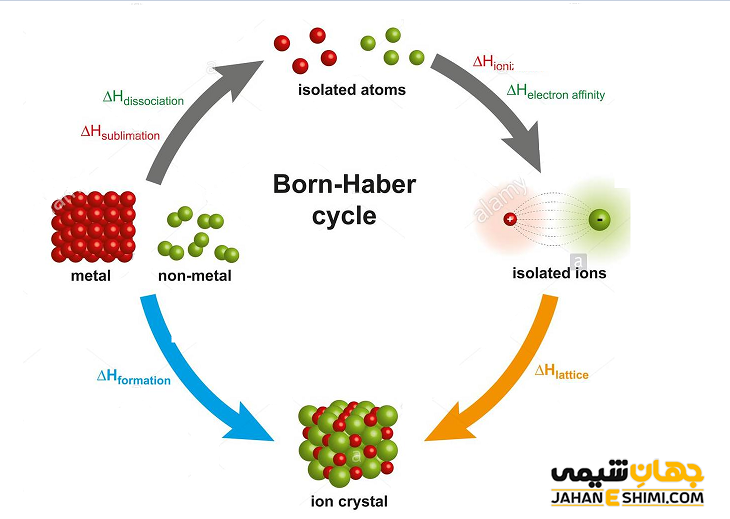
تعيين انرژی شبكه بلوری با استفاده از چرخه بورن – هابر
متاسفانه به طور معمول روش تجربی مستقيمی برای محاسبه و اندازه گيری انرژي شبكه های بلوری وجود ندارد. در حالیکه محاسبه اين انرژی برای تركيبات يونی اهميت زیادی دارد. انرژی شبكه اي را می توان با کمک داده های تجربی معين و همچنین با استفاده از چرخه بورن- هابر، اندازه گيری نمود. توجه داشته باشید که تحلیل بور – هابر بر طبق قانون هس قرار دارد. قانون هس بیان می کند که تغییرات آنتالپی در هر نوع واکنش شیمیایی مقداری ثابت می باشد، خواه واکنش شیمیایی مورد نظر در طی یک مرحله انجام شود و یا در طی چند مرحله صورت گیرد. قانون هس بر طبق اصل اول ترموديناميك یا اصل بقا انرژی بدست آمده است.
در حقیقت بورن و هابر، قانون هس را درباره آنتالپی تشكيل جامدات يونی، بکار بردند. به بیان دیگر، چرخه بورن- هابر جهت تشكيل يك بلور يونی از عناصر مربوطه خود (یعنی فلز M و غیر فلز X) به شکل زیر می باشد:
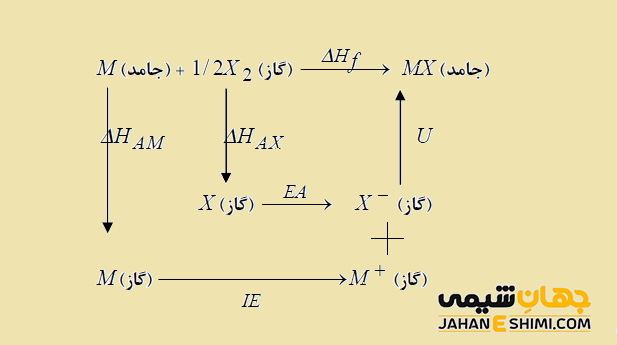
بر طبق قانون هس، آنتالپی تشكيل جامدات يونی به کمک معادله زیر محاسبه می شود.
ΔHf = ΔHAM + ΔHAX + IE + EA +U
که در آن، جملات به ترتيب عبارتند از : آنتالپی تشكيل جامد يونی (ΔHf)، آنتالپی اتمی شدن فلز (ΔHAM)، آنتالپی اتمی شدن نافلز (ΔHAX)، انرژی يونيزاسيون فلز (IE)، انرژی الكترون خواهی نافلز (EA) و انرژی شبكه بلوری (U) می باشند. لازم به ذکر است که برای غير فلزات دو اتمی گازی، ΔHAX برابر با آنتالپی تفكيك مولكول دو اتمی خواهد بود. علاوه بر آن، فلزاتی كه به شكل گاز اتمی تبخیر می شوند، آنتالپی اتمی شدن فلزی برابر با آنتالپی تصعید (ΔHs) است. حال اگر تصعيد باعث تشكيل مولكول دو اتمی گردد، آنتالپی تفكيك مولكول دو اتمی را هم بايد در نظر بگيريد.
مثال
براي درک بهتر مطلب به مثال زير توجه نمایید. به عنوان نمونه تولید یک مول بلور کلرید سدیم را از اتم های سدیم و کلر در چند مرحله تصور کنید. دقت داشته باشید که جمع جبری مقادیر ΔH در این چند مرحله بایستی بر طبق قانون هس، برابر با آنتالپی تشکیل بلور کلرید سدیم در یک مرحله باشد. در واقع، تغییرات آنتالپی تولید یک مول بلور کلرید سدیم در یک مرحله از Na (s) و (g) Cl۲ آنتالپی تشکیل این بلور می باشد.
Na (s) + 1/2 Cl۲ (g) → NaCl (s) ΔHf = -۴۱۱ kJ
این مراحل عبارتند از :
- در مرحله اول، بلور فلز سدیم تصعید می شود و در نتیجه به اتم های گازی شکل سدیم تبدیل می گردد. در این فرآیند، مقدار انرژی تصعید جذب شده سدیم برای هر مول آن برابر با ۱۰۸ کیلو ژول می باشد.
Na (s) → Na (g) ΔHs = +۱۰۸ kJ
- در مرحله دوم، نیم مول از مولکول های کلر گازی تفکیک شده و در نتیجه به یک مول اتم کلر گازی تبدیل می شود. آنتالپی تفکیک مولکول های کلر گازی که به آن انرژی پیوندی Cl- Cl نیز می گویند، برابر با ۲۴۳ کیلو ژول برای هر مول مولکول های کلر گازی است. از آنجاییکه تنها به نیم مول مولکول کلر گازی نیاز است، بنابراین انرژی تفکیک نیر نصف می شود.
½Cl۲ (g) → Cl (g) ۱/۲ ΔHf = ۱/۲ (۲۴۳ kJ) = + 121\5 kJ
- در مرحله سوم، اتم های سدیم گازی یونیزه خواهند شد و در نتیجه به کاتیون های سدیم گازی تبدیل می شوند. مقدار انرژی لازم در حقیقت همان انرژی اولین یونش سدیم می باشد.
Na (g) → Na+ (g) + e− ΔHIE= +۴۹۶ kJ
- در مرحله چهارم، اتم های کلر گازی شکل الکترون گرفته و در نتیجه به آنیون های کلرید گازی تبدیل می شوند. مقدار انرژی لازم در حقیقت برابر با اولین الکترون خواهی کلر می باشد. توجه داشته باشید که در این فآیند انرژی آزاد می شود. در واقع این اولین مرحله ای خواهد بود که در طی آن، انرژی آزاد می شود. اما لازم به ذکر است که انرژی آزاد شده در این مرحله، انرژی های مورد نیاز مراحل قبل را تامین نمی کند.
Cl (g) + e− → Cl− (g) ΔHEA = -۳۴۹ kJ
- در مرحله آخر، کاتیون و آنیون های گازی به صورت یک مول بلور کلرید سدیم متراکم می شوند. تغییر آنتالپی ای فرآیند در واقع همان انرژی شبکه بلور کلرید سدیم می باشد. این مرحله با آزاد شدن انرژی همراه است.
Na+ (g) + Cl− (g) → NaCl (s) ΔH = -۷۸۸ kJ
همانطور که مشخص است، بیشترین انرژی آزاد شده در کل این واکنش، از این مرحله آخر ناشی می شود. به بیان دیگر، مرحله ای که زمینه انجام این فرآیند را از نظر انرژی مساعد می کند همین مرحله آخر می باشد. حالا اگر معادلات گرما شیمی مراحل ۱ تا ۵ را با یکدیگر جمع کنید، دارید :
Na (s) + 1/2 Cl۲ (g) → NaCl (s) ΔHf = -۴۱۱ kJ
توجه داشته باشید که مقادیری که از چرخه بورن -هابر بدست می آیند، تغییرات آنتالپی می باشند. در مثال فوق، آنتالپی تشکیل بلور کلرید سدیم از عناصر سازنده آن، در پنج مرحله مختلف توضیح داده شد. این پنج مرحله عبارتند از:
- آنتالپی اتمیزه شدن سدیم
- آنتالپی اتمیزه شدن کلر
- آنتالپی یونش سدیم
- آنتالپی الکترون خواهی کلر
- آنتالپی شبکه بلور کلرید سدیم
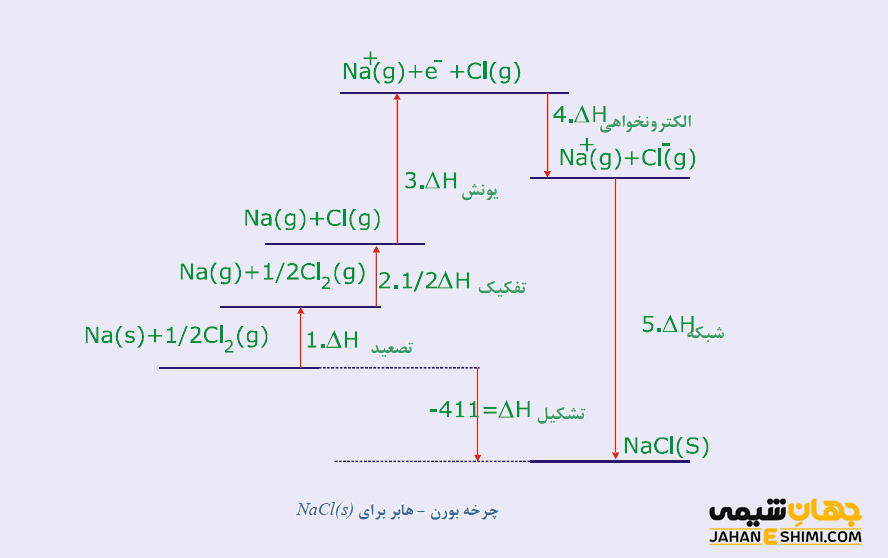
در واقع، این فرآیند را همچنین می توان به صورت نمودار نشان داد، بدین ترتیب نحوه اضافه شدن هرکدام از ۵ مورد بالا قابل مشاهده خواهد بود. این نمودار در شکل بالا نشان داده شده است.




















