
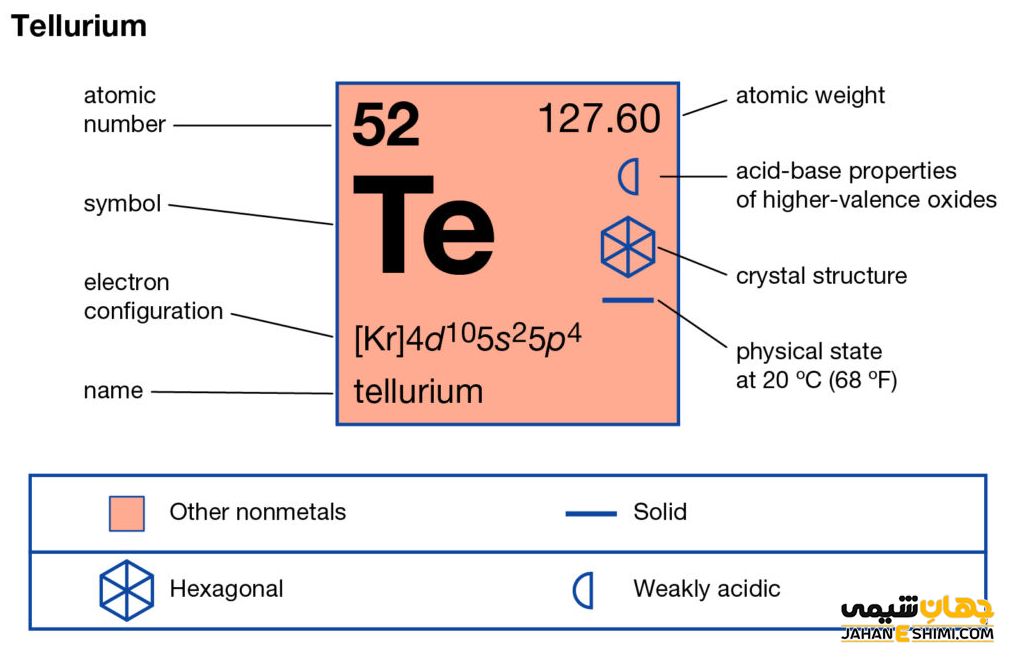
عنصر تلوریم (Tellurium) با نماد شیمیایی Te، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۵۲ می باشد. این عنصر در حقیقت پنجاه و دومین عنصر از جدول تناوبی بوده که در گروه XVI و دوره پنجم جدول تناوبی قرار دارد. در واقع عنصر تلوریم یک شبه فلز بسیار شکننده و به رنگ سفید نقره ای و از عناصر گروه کالکوژن یا خانواده اکسیژن است. این فلز با عناصر اکسیژن (O)، گوگرد (S)، سلنیوم (Se)، پولونیوم (Po) و لیورمیوم (Lv)، در گروه شانزدهم یا گروه ششم اصلی (VIA) جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر تلوریوم پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تاریخچه کشف عنصر تلوریم
۲- پیدایش و منابع عنصر شماره ۵۲ جدول تناوبی
۳- ویژگی های فیزیکی و شیمیایی عنصر تلوریم
۱-۳- شبه فلز
۴- ایزوتوپ های عنصر تلوریوم
۵- کاربرد های عنصر تلوریم
۶- ترکیبات عنصر تلوریم
۷- خطرات تلوریم بر روی سلامتی انسان
تاریخچه کشف عنصر تلوریم
برای نخستین بار در سال ۱۷۸۲ میلادی، کانی شناس اتریشی به نام فرانتس-جوزف مولر فون رایشنشتین (Joseph Muller von Reichstein) عنصر تلوریم را کشف کرد. او بازرس ارشد معادن ذوب و استخراج نمک در ترانسیلوانیا بود. او که علاقمند به شیمی و استخراج فلزات بود، توانست از کانی طلا (به نام اوروم آلبوم) ماده ای استخراج کند که شبیه آنتیموان بود. وی خیلی زود متوجه شد، فلزی که استخراج کرده است به هیچ وجه آنتیموان نیست. در حقیقت یک عنصر جدید و نا شناخته دیگر است. متاسفانه با مقدار کمی که از این ماده جدید در اختیار داشت، نتوانست چیز بیشتری درباره این عنصر به ظاهر جدید و ناشناخته کشف کند. وی برای تاييد كشف خود، نمونه ای از اين عنصر را برای شيميدان آلمانی، مارتین هاینریش کلاپروت (Martin Heinrich Klaproth) فرستاد.
کارهای مولر تا سال ۱۷۹۸ میلادی نادیده گرفته شد. تا اینکه کلاپروت، این ماده را در گزارشات خود مطرح نمود. کلاپروت تمام اعتبار کشف عنصر تلوریوم را به نام جوزف مولر ثبت کرد. از آنجاییکه تا آن روز، نام تعدادی از عناصر شیمیایی از روی جرم های آسمانی گرفته شده بود، کلاپروت اندیشید که دیگر نوبت آن رسیده است به افتخار زمین، عنصری نامگذاری شود. بنابراین نام تلوریوم از کلمه لاتین تلوس (tellus) به معنای زمین یا نشات گرفته از زمین گرفته شده است.

پیدایش و منابع عنصر شماره ۵۲ جدول تناوبی
عنصر تلوریوم درصد فراوانی کمی در پوسته زمین دارد. این ماده در طبیعت به صورت آزاد به شکل خالص یافت می شود. اما آن را بیشتر می توان در کانی های سیلوانیت (AgAuTe۴)، کالاوریت (AuTe۲) و کرنریت (AuTe۲) و در ترکیب با سایر فلزات پیدا کرد. امروزه بیشترین منبع اصلی تلوریم، محصولات جانبی استخراج و تصفیه مس و سرب است.

ویژگی های فیزیکی و شیمیایی عنصر تلوریم
عنصر تلوریم، بسیار شکننده، جامد جلادار و با مشخصات فلزی است که به راحتی له می شود. به عبارت دیگر، این عنصر در حالت بلوری خود به رنگ سفید- نقره ای و در حالت خالص دیگر درخشش فلزی دارد. خصوصیات قابل توجه تلوریوم از ساختار اتمی آن ([۳۶Kr] 4d۱۰۵s۲۵p۴) ناشی می شود. همانطور که مشخص است، اوربیتال p لایه آخر در این عنصر در حال پر شدن است. این عنصر دارای دو اوربیتال نیمه پر و یک اوربیتال پر در اوربیتال p خود است. از این رو می تواند در دو پیوند کووالانسی شرکت کند. پس حالت های اکسیداسیون +۲ و -۲ را خواهد داشت. همچنین با توجه به آرایش الکترونی آن مشخص است که شش الکترون در دورترین لایه الکترونی آن وجود دارد.
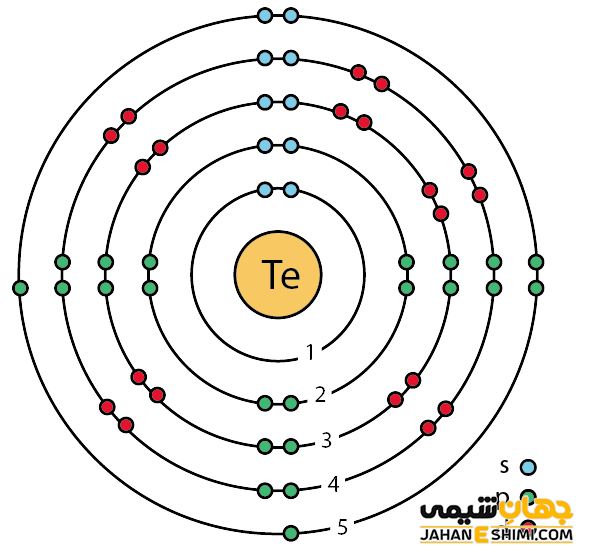
توجه داشته باشید که تلوریوم یک عنصر شیمیایی به نسبت کمیاب و نیمه فلزی (Semimetallic) است. در واقع از نظر خصوصیات فیزیکی و ظاهری شبیه فلزات است. در حالیکه از لحاظ شیمیایی مانند نا فلزات عمل می کند. همانطور که گفته شد، عنصر شماره ۵۲ جدول تناوبی متعلق به خانواده اکسیژن است. این شبه فلز شبیه عنصر قلع است، در حالیکه از نظر شیمیایی مثل عناصر سلنیوم و گوگرد رفتار می کند. از طرفی از نیم رسانای نوع پی (p-type) بوده که رسانایی آن نسبت به نور حساس می باشد. در واقع رسانایی آن در صورت مواجهه با نور تا حدودی افزایش پیدا می کند. تلوریم را میتوان به فلزات دیگر از جمله طلا، مس، نقره و قلع اضافه کرد. توجه داشته باشید که این عنصر در حالت مذاب می تواند باعث فرسایش مس، آهن و فولاد ضد زنگ گردد.
جالب است بدانید که
عنصر شماره ۵۲ جدول تناوبی در آب نا محلول است. در حالیکه با اسید سولفوریک، اسید نیتریک، محلول سیانید پتاسیم و هیدروکسید پتاسیم واکنش می دهد. بوی تلوریم نظیر بوی سیر است. شکل های قابل دسترس آن معمولا به صورت شمش، تخته ای، لوله ای، گرد و پودر است. همچنین در هنگام سوختن در هوای عادی، شعله هایی به رنگ آبی مایل به سبز تولید می کند (به دلیل تولید اکسید تلوریم). از دیگر ویژگی های عنصر تلوریوم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۴۴۹.۵۱ و ۹۸۸ درجه سانتی گراد است.
- عنصر تلوریم دیا مغناطیس است.
- ساختار بلوری آن به شکل سه گوشه (Trigonal) است.
- این عنصر دو آلوتروپ دارد. یکی شکل کریستالی یا بلوری و دیگری فرم آمورف.
- جرم اتمی تلوریم برابر با ۱۲۷.۶ g/mol است.
- چگالی آن نیز برابر با ۶.۲۴ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۱۲۳ pm می باشد.
- یون های تلوریم معمولا عدد اکسایش برابر با اعداد -۱، -۲، ۰، +۱،+۲ ، +۳، +۴، +۵و +۶ دارند. در حقیقت یک اکسید اسیدی ملایم محسوب می شود. اعداد اکسایش -۲، ۰،+۲ ، +۴ و +۶ متداول تر می باشند.
- اولین انرژی یونیزاسیون آن برابر با ۸۶۹.۳ kJ/mol است.
شبه فلز
شبه فلز یا فلزوار (Metalloid) به عناصری از جدول تناوبی گفته می شود که خواص آنها میان فلزات و نافلزات است. به طور کلی خواص فیزیکی آنها بیشتر شبیه به فلزات، اما رفتار شمیایی آنها همانند نافلزات است. این دسته از عناصر شیمیایی، معمولا سطح صیقلی و براقی دارند. در اثر ضربه خوردن خرد می شوند. در نتیجه می شکنند، از این رو چکش خوار نیستند. به عبارت دیگر، شبه فلزات جامد هایی شکننده با ظاهری فلزی می باشند. این دسته عناصر تمایل دارند که در طی واکنش با سایر اتم ها، الکترون های خود را به اشتراک بگذارند.
از دیگر خواص آنها اینست که بیشتر نیمه هادی بوده و رسانایی گرمایی متوسطی نیز دارند. برخی از آنها مانند آرسنیک و آنتیموان، الکتریسیته را مانند فلزات هدایت می کنند. همچنین دارای اکسید های آمفوتری یا اسیدی ضعیف می باشند. این عناصر بیشتر به صورت ترکیب وجود دارند. شش شبه فلز شناخته شده عبارتند از : عناصر بور، سیلیکون، ژرمانیوم، آرسنیک، آنتیموان و تلوریوم.
ایزوتوپ های عنصر تلوریوم
همانطور که می دانید، ایزوتوپ های یک عنصر، در تعداد نوترون ها با یکدیگر تفاوت دارند. عنصر تلوریوم ایزوتوپ های فراوانی دارد. تلوریومی که در طبیعت وجود دارد دارای هشت ایزوتوپ ۱۲۰Te (0.09 %)، ۱۲۲Te (2.55 %)، ۱۲۳Te (0.89 %)، ۱۲۴Te (4.74 %)، ۱۲۵Te (7.07 %)، ۱۲۶Te (18.84 %)، ۱۲۸Te(31.74 %) و ۱۳۰Te (34.08 %) می باشد. دقت داشته باشید که فقط شش ایزوتوپ ۱۲۰Te، ۱۲۲Te، ۱۲۴Te ، ۱۲۵Te، ۱۲۶Te و ۱۲۸Te پایدار هستند. دو مورد دیگر رادیواکتیو می باشند. لازم به ذکر است که دو ایزوتوپ ۱۳۰Te و ۱۳۰Te فقط کمی پرتوزا می باشند، زیرا نیمه عمر طولانی دارند. علاوه بر آن، ۳۰ رادیو ایزوتوپ مصنوعی تلوریوم نیز شناخته شده است. عدد جرمی این ایزوتوپ ها از ۱۰۸ تا ۱۳۷ گزارش شده است. در جدول زیر نیمه عمر تعدادی از ایزوتوپ های تلوریوم را مشاهده می کنید.
| نیمه عمر | ایزوتوپ |
| ۴/۶۹ روز | Te-119 |
| ۱۶/۸ روز | Te-121 |
| ۱۵۴ روز | Te-121m |
| E12 1.3 سال | Te-123 |
| ۱۱۹/۷ روز | Te-123m |
| ۵۸ روز | Te-125m |
| ۹/۴ ساعت | Te-127 |
| ۱۰۹ روز | Te-127m |
| ۱/۱۶ ساعت | Te-129 |
| ۳۳/۶ روز | Te-129m |
| ۲.۵E21 سال | Te-130 |
| ۲۵ دقیقه | Te-131 |
| ۱/۳۵ روز | Te-131m |
| ۳/۲۶ روز | Te-132 |
| ۱۲/۴ دقیقه | Te-133 |
| ۵۵.۴ دقیقه | Te-133m |
| ۴۱.۸ دقیقه | Te-134 |

کاربرد های عنصر تلوریم
عنصر تلوریم کاربرد های بسیار زیادی در صنایع مختلف از جمله تولید آلياژ ها و علم الکترونیک دارد. تلوریوم اغلب برای ساخت آلیاژ با فلزات دیگر کاربرد دارد. اضافه کردن مقادیر اندکی از این فلز به مس و فولاد زنگ نزن، باعث بالا بردن خاصیت ماشین کاری و همچنین افزایش کارآمدی آنها می گردد. این عنصر می تواند به سرب اضافه شود تا استحکام و دوام سرب را افزایش دهد. همچنین می تواند تاثیر فرسایشی اسید سولفوریک بر سرب را کاهش دهد. علاوه بر آن، تلوریوم برای کنترل سرما می تواند به صورت چدن آلیاژ شود. علاوه بر آن، در بعضی فولاد ها به منظور افزايش حالت پذيري آنها کاربرد دارد. همانطور که بیان شد، تلوریم یک نیمه هادی است و می تواند با فلزات مس، سرب، طلا و نقره آلاییده شود.
عنصر شماره ۵۲ جدول تناوبی به عنوان عامل رنگ کننده در شیشه و سرامیک بکار می رود. در واقع از تركيبات تلوريوم به عنوان پودر رنگ های شيشه اي آبی- قهوه ای بهره می برند. از طرفی دیگر، یکی از مواد اولیه به منظور ساخت کلاهک های انفجاری محسوب می شود. ترکیب شیمیایی تلوریوم- بیسموت در وسایل ترمو الکتریک استفاده می شود. از دیگر کاربرد های تلوریوم می توان به عامل سختکننده ثانوی لاستیک، تولید آهن و فولاد ضد زنگ ریختگی، به عنوان یک اکسید کننده، ساخت لوله و روكش كابل، کاتالیزور ها و باتری های ذخیره در سفینه ها اشاره کرد. به علاوه، تلوریوم کاربرد های بالقوه در پهنه های آفتابگیر تلوریم-کادمــیم دارد. در حقیقت قسمتی از راندمان بالای تولید برق در سلول های خورشیدی به دلیل استفاده از این ماده است. اما لازم به ذکر است که از این کاربرد در عمل هنوز استقبال نشده است.
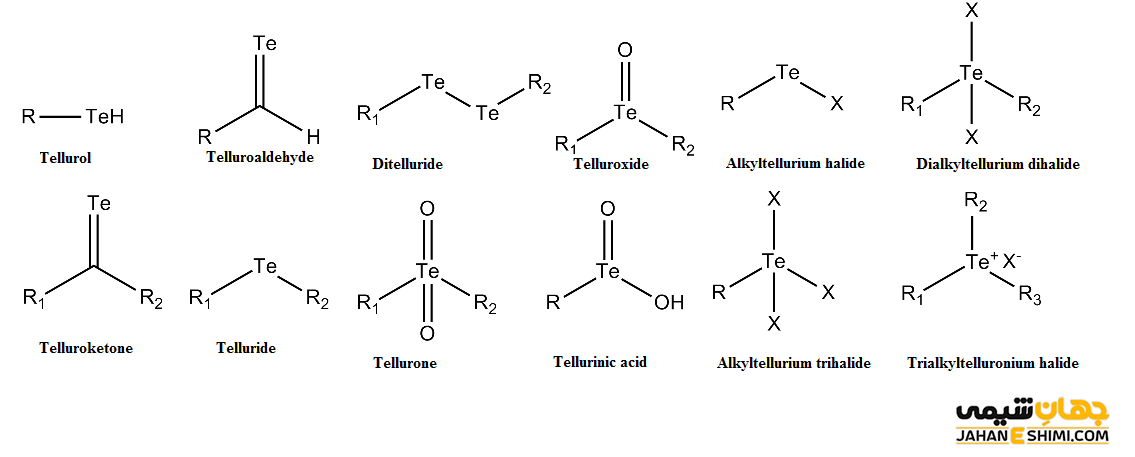
ترکیبات عنصر تلوریم
همانطور که بیان شد عنصر تلوریم در گروه عناصر گوگرد و سلنیوم قرار گرفته است. پس ترکیباتی مشابه آنها می سازد. توجه داشته باشید که ترکیب تلوریوم با سایر فلزات، هیدروژن و یون های مشابه، با نام تلورید نامیده می شود. به عنوان مثال، تلورید های طلا و نقره کانه های خوبی محسوب می شوند. اکسید تلوریوم یکی از ترکیبات کاربردی فلز تلوریوم است. این فلز همچنین می تواند به راحتی با کربن و هالوژن ها واکنش دهد و در نتیجه ترکیبات اورگانو تلوریم و هالید تولید نماید. از دیگر ترکیبات آن می توان به موارد زیر اشاره کرد.
- تلوریم تری اکسید (TeO۳)
- تلوریم دی اکسید (TeO۲)
- تلوریم مونو اکسید (TeO)
- تلوریم هگزا فلوئورید (TeF۶)
- تلوریم تترا کلرید (TeCl۴)
- تلوریم تترا یدید (TeI۴)
- تلوریم تترا فلوئورید (TeF۴)
- تلوریم دی کلرید (TeCl۲)
- تری تلوریم دی کلرید (Te۳Cl۲)
- سدیم تلورید (Na۲Te)
- تلورس اسید (H۲TeO۲)
- تلورید تنگستن (WTe۲)
خطرات تلوریم بر روی سلامتی انسان
خوشبختانه مردم خیلی به ندرت در زندگی روزمره با ترکیبات تلوریوم مواجه می شوند. این ترکیبات تراتوژنیک می باشند. شیمیدانان معتقد هستند که خوردن آن حتی به میزان بسیار کم می تواند باعث بوی بد دهان و بدن شود. این ماده شیمیایی از طریق تنفس گرد و غبار جذب بدن انسان می شود. تبخیر تلوریوم در دمای ۲۰ درجه سانتیگراد بسیار کم است. اما توجه داشته باشید که زمانی منتشر شود، به سرعت غلظت ذرات موجود در هوا افزایش پیدا می کند. گرد و غبار تلوریم، می تواند چشم و مجاری تنفسی را بسوزاند. همچنین بر روی کبد و سیستم عصبی مرکزی اثر منفی می گذارد.
لازم به ذکر است که با گرم کردن تلوریم، بخارات سمی ایجاد می شود. این عنصر به شدت با هالوژن ها یا اینتر هالوژن ها واکنش می دهد، در نتیجه خطر آتش سوزی به همراه دارد. به علاوه، با نور خیره کننده و شدیدی با روی واکنش می دهد. ترکیب سیلیسید لیتیم نیز با نور خیره کننده ای با تلوریوم درگیر واکنش می شود. این ترکیب قابل احتراق است. در نتیجه ذرات حاصل از این مخلوط انفجاری، در هوا پراکنده خواهند شد. از اثرات تنفس آن می توان به خواب آلودگی، خشک شدن دهان، ایجاد مزه فلز، بوی سیر، سردرد و حالت تهوع اشاره کرد. اثرات ناشی ازخوردن آن عبارتند از : شکم درد، یبوست و استفراغ. دقت داشته باشید که تلوریوم هیچ عملکرد بیولوژیکی ندارد.




















