
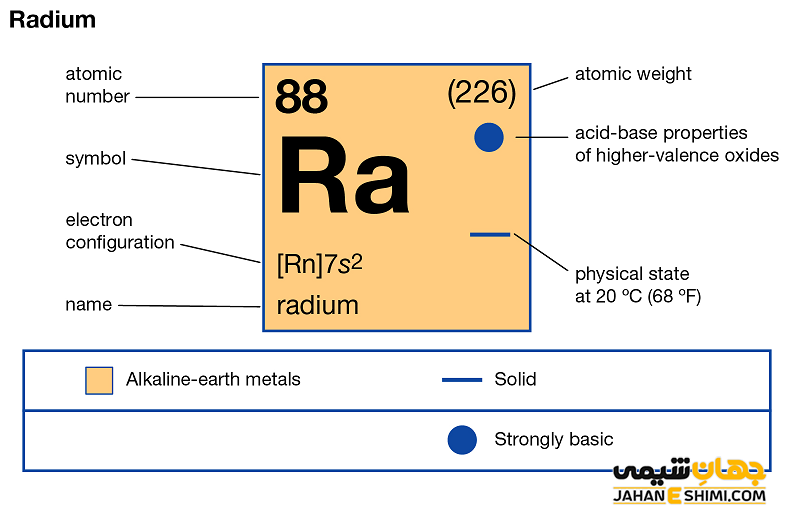
عنصر رادیوم (Radium) با نماد شیمیایی Ra، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۸۸ می باشد. این عنصر در حقیقت هشتاد و هشتمین عنصر از جدول تناوبی بوده که در گروه IIA و دوره هفتم جدول تناوبی قرار گرفته است. در واقع عنصر رادیوم یک فلز رادیواکتیو و به رنگ سفید درخشان یا نقره ای است که به عناصر گروه فلزات قلیایی خاکی تعلق دارد. این فلز با عناصر بریلیوم (Be)، منیزیم (Mg)، کلسیم (Ca)، استرانسیم (Sr) و باریوم (Ba)، در گروه دو اصلی جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر رادیم پرداخته می شود. لطفا با ما همراه باشید.
تاریخچه کشف عنصر رادیوم
عنصر رادیوم برای اولین بار در سال ۱۸۹۵ میلادی، توسط ماری کوری (Marie Curie) و همسرش پیر کوری (Pierre Curie) در پاریس کشف شد. در حقیقت ماری کوری تکه ای از فلز اورانیم را لای کاغذ سفید رنگی گذاشته بود. او این کاغذ را به طور اتفاقی بر روی نگاتیو فیلم نور ندیده ای قرار داده بود. در فردای آن روز، مشاهده کرد که نگاتیو فیلم، مانند زمانیکه نور دیده باشد سیاه شده است. وی متوجه شد که پرتو هایی از آن تکه اورانیم خارج شده است. این پرتو ها قطعا از کاغذ عبور کرده اند و باعث سیاه شدن نگاتیو شده اند.
برای تایید این مشاهده، آنها در فردای آن روز همین عمل را با یک سنگ پیچبلند (کانی داری اورانیم) انجام دادند. در نتیجه نگاتیو با شدت بسیار بیشتری سیاه شد. در نهایت نتیجه گرفتند که عنصری ناشناخته و بسیار رادیواکتیو تر از اورانیم در آن سنگ وجود دارد. ماری کوری و همسرش به جستجوی این عنصر جدید پرداختند و تنوانستند رادیوم را کشف کنند.

به عبارت دیگر، ماری و همسرش در طی تحقیقاتشان بر روی اورانیت (پس از جدا کردن اورانیوم از اورانیت) به ماده ای جدید برخورد کردند که هنوز خاصیت رادیواکتیوی خود را حفظ کرده است. آنها با این عمل توانستند یک مخلوط رادیواکتیو جدا کنند. بیشتر این مخلوط رادیواکتیو را باریوم که دارای شعله ای قرمز رنگ و درخشان است، تشکیل داده بود. در نهایت و بعد از جدا کردن سایر ترکیبات (اغلب باریم) از مخلوط رادیواکتیو، مشاهده شد که ماده حاصل شده با رنگ سبز روشن و درخشان می سوزد. خطوط طیفی آن نیز با مستندات آن زمان متفاوت به نظر می رسید.
نامگذاری رادیوم
بدین شکل عنصر رادیوم به عنوان عنصری جدید در تاریخ ۲۶ دسامبر سال ۱۸۹۸ میلادی، به ثبت آکادمی علوم فرانسه رسید. لازم به ذکر است که رادیوم خالص در سال ۱۹۰۲ میلادی به وسیله فرآیند الکترولیز محلول کلرید رادیوم به کمک الکترود جیوه و همچنین تقطیر گاز هیدروژن توسط کوری و آندره دبیرن (Andre Debierne) بدست آمده است. واژه رادیوم از کلمه یونانی ری (ray) به معنای پرتو گرفته شده است. این کلمه به خروج پرتو ها از عنصر رادیوم اشاره می کند. لازم به ذکر است که کشف عنصر رادیوم باعث تغییرات اساسی در دانش بشر در مورد خواص و ساخت ماده شد. بدین صورت، کشف رادیم سبب شناخت و دستیابی به انرژی اتمی گردید.
پیدایش و منابع عنصر شماره ۸۸ جدول تناوبی
همانطور که بیان شد، خانم و آقای کوری فلز رادیم را در اورانیت پیدا کردند. بنابراین از آن جهت که عنصر رادیوم یکی از محصولات تجزیه ای اورانیوم محسوب می شود، پس در معادن اورانیوم وجود دارد. از آنجاییکه رادیوم همراه با اورانیوم است، بنابراین باید سنگ معدن اورانیوم طی یکسری فرآیند های گسترده فرآوری شود تا رادیوم از آن استخراج گردد. مقادیر زیادی از رادیم در شهری از کشور آلمان و در معدن بوهمیا یواخیمستال (Joachimsthal Bohemia)) پیدا می شود. جالب است بدانید که اگر کانی اورانیت دارای پنجاه درصد دی اکسید اورانیوم باشد، برای استخراج و بدست آوردن تنها یک گرم از عنصر رادیوم، چیزی در حدود هشت تن اورانیت، نیاز است. توجه داشته باشید که بزرگ ترین معدن ذخیره پچبلند، در منطقه دریاچه خرس بزرگ کانادا قرار دارد.
لازم به ذکر است که کانی های غنی از رادیوم در مناطقی همچون دریاچه های بزرگ (Greate Lake)، کشور کانادا و جمهوری دموکراتیک کونگو وجود دارند. به بیان دیگر، ذخایر بزرگ سنگ معدن اورانیوم در شهر های نیو مکزیکو، انتاریو، یوتا و استرالیا یافت شده اند. علاوه بر آن، رادیوم از ماسه های کارنوتیت (Carnotite) شهر کلرادو نیز استخراج می گردد. همچنین می توان رادیوم را به صورت تجاری از کلرید ها و برومید ها بدست آورد. این عنصر را همچنین می توان از ضایعات اورانیوم بدست آورد.

ویژگی های فیزیکی و شیمیایی عنصر رادیوم
رادیوم یک فلز شیمیایی بسیار رادیواکتیو است. زمانیکه در تاریکی قرار بگیرد، به دلیل خاصیت رادیواکتیو بودن می درخشد. خصوصیات قابل توجه رادیوم از ساختار اتمی ([۸۶Rn] 7s۲) آن ناشی می شود. همانند دیگر فلزات قلیایی خاکی، دو الکترون در دورترین لایه الکترونی رادیوم وجود دارد. فاصله این دو الکترون تا هسته اتم رادیوم، نسبت به فاصله الکترون های نظیر در سایر فلزات قلیایی خاکی از جمله اتم های بریلیم، منیزیم، کلسیم، استرانسیم و یا باریم بیش تر است. بنابراین این الکترون های لایه ظرفیت به آسانی جذب سایر اتم ها می شود. در نتیجه رادیوم یک فلز دوظرفیتی است.
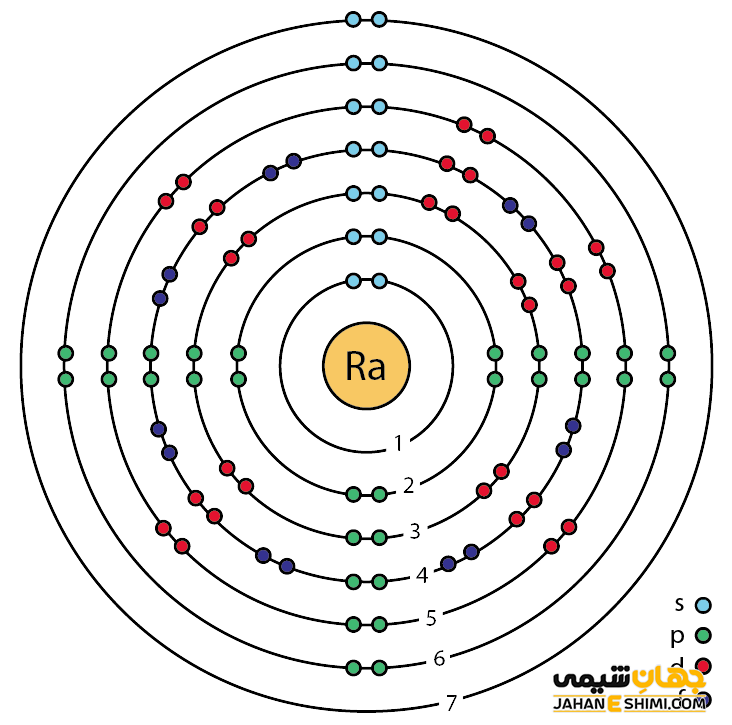
دقت داشته باشید که خواص شیمیایی عنصر رادیوم شباهت زیادی به فلز باریم دارد. این عنصر، سنگین ترین عنصر در میان فلزات قلیایی خاکی در جدول تناوبی است. فلز رادیوم به شکل خالص به رنگ سفید براق دیده می شود. اما زمانیکه در مجاورت هوا قرار بگیرد، به رنگ سیاه تغییر می کند. احتمالا، سیاه شدن به دلیل وجود ساختار های نیتریدی است. در واقع رادیم با نیتروژن موجود در هوا واکنش می دهد، بنابراین به سرعت، یک پوشش سیاه رنگ از نیترید رادیوم تشکیل می شود. همانطور که بیان شد، رادیوم فلزی درخشان است که رنگ آبی کمرنگ از خود منتشر می کند.
رادیوم نیز مانند سایر فلزات قلیایی به شدت با آب واکنش نشان می دهد. در این صورت، گاز هیدروژن و هیدروکسید رادیوم تولید می شود. لازم به ذکر است که شدت واکنش رادیوم با اسید هیدروکلریک به منظور تشکیل کلرید رادیوم، حتی از واکنش با آب نیز شدید تر خواهد بود. رادیوم به آسانی بر روی فیلم عکاسی اثر می گذارد. شدت این تاثیر حتی زمانیکه فیلم در کاغذ ضد نور پیچیده شده باشد نیز دیده می شود.
خواص ویژه رادیوم رادیواکتیو
رادیوم در حقیقت یک عنصر بسیار عجیب است. این عنصر، پایدار ترین عنصر رادیو اکتیو محسوب می شود. می توان گفت که قدرت رادیواکتیویته آن میلیون ها بار بیشتر از اورانیوم می باشد. این عنصر در حالت رادیواکتیویته یا پرتو زایی، ذرات آلفا، بتا و همچنین اشعه گاما منتشر می کند. به علاوه، زمانیکه با بریلیوم مخلوط شود، می تواند نوترون تولید نماید. دقت داشته باشید که گرمایى که از این عنصر بدست می آید، در حدی است که می تواند در هر یک ساعت چیزی در حدود یک برابر و نیم وزن خود، یخ را آب کند. جالب است بدانید که این انرژی حرارتی از خود رادیوم تولید می شود. به بیان دیگر، رادیوم به اتم های ساده تر تجزیه شده و گرما ایجاد می کند. از دیگر ویژگی های عنصر رادیم می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۷۰۰ و ۱۷۳۷ درجه سانتی گراد است.
- عنصر رادیوم دیا مغناطیس است.
- ساختار بلوری آن به شکل مکعبی مرکز پر (bcc) است.
- این عنصر آلوتروپ ندارد.
- جرم اتمی رادیوم برابر با ۲۲۶.۰۲۵ g/mol است.
- چگالی آن نیز برابر با ۵.۵ g/cm۳ می باشد.
- شعاع اتمی آن نیز برابر با ۲۱۵ pm می باشد.
- یون های رادیوم معمولا عدد اکسایش برابر با اعداد،۰ و +۲ را دارند. از این جهت پیش بینی می شود که به عنوان اکسید بازی بسیار قوی عمل کند. اعداد اکسایش +۲ متداول تر می باشد.
- انرژی یونیزاسیون آن برابر با ۵۰۹.۳ kJ/mol است.
- عنصر رادیوم در دسته گرانبها ترین و کمیاب ترین فلزات جهان قرار دارد.
ایزوتوپ های عنصر رادیوم
همانطور که در مقالات پیشین نشریه بیان شده است، ایزوتوپ های یک عنصر، تنها در تعداد نوترون ها با یکدیگر تفاوت دارند. رادیوم به طور طبیعی ایزوتوپ پایداری ندارد. بنابراین برای آن، جرم اتمی استانداردی تعریف نشده است. رادیوم دارای ۲۵ ایزوتوپ گوناگون است که تنها چهار تای آن در طبیعت وجود دارند. ایزوتوپ های ۲۲۳Ra ، ۲۲۴Ra، ۲۲۶Ra و ۲۲۸Ra همه از تجزیه عناصر اورانیوم یا توریوم بوجود می آیند. پایدار ترین ایزوتوپ رادیواکتیو آن، ایزوتوپ پرتوزای ۲۲۶Ra است که نیمه عمر آن برابر با ۱۶۲۲ سال می باشد. لازم به ذکر است که عنصر رادیوم در هر بیست و پنج سال، یک درصد از فعالیت خود را از دست می دهد، زیرا به عناصری با وزن های اتمی کمتر تبدیل می شود. در واقع سرب، آخرین محصول تجزیه عنصر رادیوم است.

کاربرد های عنصر رادیوم
عنصر رادیوم در گذشته برای تولید رنگ های براق، رنگ های شب نما، ساعت های شب نما، کلید های هواپیما، صفحات سوختی هسته ای و صفحات نشان گر (مانند کیلومتر شمار ماشین) مورد استفاده قرار می گرفت. اما متاسفانه به دلیل رادیواکتیو و پرتوزا بودن این رنگ ها، باعث مرگ کسانی که از این رنگ ها استفاده می کردند، شد. از این جهت، استفاده از آن در قانون ممنوع شده است. امروزه این عنصر با عنصر تریتیوم جایگزین شده است. عنصر رادیم اگر با عنصر بریلیم مخلوط شود، می تواند به عنوان یک منبع نوترونی جهت آزمایشات فیزیکی بکار رود. دقت داشته باشید که به دلیل کمیاب بودن رادیوم، ارزش آن چندین برابر دیگر فلزات با ارزشی مانند طلا است. امروزه جهت تولید جواهر، از پوشش رادیوم استفاده می کنند.

ماری کوری متوجه شد که رادیوم می تواند بر روی بافت بدن اثر گذاشته و آن را از بین ببرد. بنابراین از آن می توان جهت درمان سرطان و یا سایر بیماری های پوستی بهره برد. بنابراین رادیم در گذشته در پزشکی نیز کاربرد داشته است. این عنصر اثرات شفا بخشی را در درمان بسیاری از اختلالات روانی و روماتیسم، در قرن ۱۹ میلادی نشان داده است. امروزه استفاده از آن، منسوخ شده است. امروزه رادیم در رادیوایزوتوپ های پزشکی کاربرد دارد. از آنجاییکه رادیوم، اشعه گاما از خود منتشر می کند، بنابراین در درمان سرطان استفاده می شود. به عنوان مثال، رادیوم برمید برای درمان سرطان های خوش خیم مورد استفاده قرار می گیرد. به علاوه جهت درمان از ترکیب برمید رادیوم با کلرید رادیوم استفاده می کنند. از طرفی دیگر، کلرید رادیوم همچنین برای تولید گاز رادون جهت درمان سرطان استفاده می شود.

ترکیبات عنصر رادیوم
ترکیبات رادیوم به دلیل رادیواکتیو بودن و داشتن نیمه عمر کوتاه، بسیار کمیاب می باشند. این ترکیبات به رنگ قرمز عمیق با سایه ای از رنگ بنفش مشاهده می شوند. آنها طیف مشخصی را ایجاد می کنند. پیش بینی می شود که این فلز، یک عامل کاهنده فعال باشد. بنابراین می تواند به راحتی با هالوژن ها و اکسیژن واکنش دهد. در نتیجه هالید ها و اکسید را تولید می کند. در ادامه مقاله ترکیبات مهم رادیوم را مشاهده می کنید.
- اکسید رادیم (RaO)
- کلرید رادیم II (RaCl۲)
- فلورید رادیوم II (RaF۲)
- یدید رادیوم II (RaI۲)
- برمید رادیم II (RaBr۲)
خطرات رادیم بر روی سلامتی انسان
عنصر رادیم در طبیعت در مقادیر بسیار اندک یافت می شود. در حالیکه امروزه به دلیل فعالیت های انسانی، سطح رادیم موجود در محیط اطراف ما افزایش یافته است. همانطور که بیان شد، عنصر رادیوم سمی بوده و به شدت رادیواکتیو می باشد. محصول تجزیه رادیوم، یعنی رادون برای ریه و شش ها بسیار کشنده است. از آنجاییکه رادیوم با عنصر کلسیم در ارتباط است، بنابراین می تواند صدمات جدی و جبران ناپذیری را به دلیل جایگزینی در استخوان بوجود آورد. به عبارت دیگر، رادیوم مثل کلسیم در بدن عمل کرده و در استخوان ها ته نشین می شود. حال اگر پرتو های رادیواکتیو مغز استخوان را تحت تاثیر قرار دهند می توانند سلول های استخوانی را تغییر دهند.
دقت داشته باشید که استنشاق، تزریق و یا حتی تماس بدنی با رادیوم می تواند باعث سرطان و یا مشکلات جسمی دیگری مانند زخم، خرابی دندان ها، کم خونی و آب مروارید و سرطان استخوان شود. در حقیقت انرژی منتشر شده از رادیوم، می تواند گاز ها را به یون تبدیل کند. بنابراین بر روی صفحات عکاسی تاثیر می گذارد و می تواند باعث بوجود آمدن زخم بر روی پوست شود. میزان این تاثیرات در واقع به مقدار رادیوم موجود بستگی دارد نه به نحوه ترکیب شیمیایی آنها.



















