
عنصر استرانسیوم (Strontium) با نماد شیمیایی Sr، یکی از عناصر شیمیایی جدول مندلیف است که عدد اتمی آن ۳۸ می باشد. این عنصر در حقیقت سی و هشتمین عنصر از جدول تناوبی بوده که در پایین گروه فلزات قلیایی خاکی قرار دارد. در واقع عنصر استرانسیم یک فلز نرم به رنگ زرد نقره ای است که در تناوب پنجم و گروه فلزات قلیایی خاکی جدول تناوبی قرار گرفته است. این فلز با عناصر بریلیوم (Be)، منیزیم (Mg)، کلسیم (Ca)، باریم (Ba) و رادیوم (Ra) در گروه دو اصلی (IIA) جدول تناوبی قرار گرفته است. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی عنصر استرانسیم پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تاریخچه کشف عنصر استرانسیوم
۲- پیدایش و منابع عنصر شماره ۳۸ جدول تناوبی
۳- ویژگی های فیزیکی و شیمیایی عنصر استرانسیوم
۴- ایزوتوپ های عنصر استرانسیوم
۵- کاربرد های عنصر استرانسیوم
۶- ترکیبات عنصر استرانسیوم
۷- خطرات استرانسیوم بر روی سلامتی انسان
۸- طریقه نگه داری فلز استرانسیم
تاریخچه کشف عنصر استرانسیوم
کانی استرونسیانیت برای اولین بار در سال ۱۷۸۷ میلادی، توسط دو شیمیدان برجسته انگلیسی به نام های ادیر کراوفورد (Adaor Crawfprd) و توماس چارلز هوپ (Thomas Charles Hope) در دهکده استرانسین (Strontian) در اسکاتلند یافت شد. این دو دانشمند در بررسی های خود بر روی کانی استرونسیانیت، اکسید فلز نا شناختهای را در آن مشاهده کردند. از طرفی، این کانی با دیگر کانی های باریم متفاوت بود. در سال ۱۷۹۸ میلادی، عنصر استرانسیوم توسط کلاپروس (Klaproth) و هوپ کشف شد. همانطور که مشخص است، نام عنصر از محل کشف آن (دهکده اسکاتلندی) گرفته شده است. لازم به ذکر است که فلز خالص استرانسیوم برای اولین بار توسط داوی (Sir Humphrey Davy) در سال ۱۸۰۸ میلادی، به کمک فرآیند الکترولیز بدست آمده است.

پیدایش و منابع عنصر شماره ۳۸ جدول تناوبی
این عنصر در طبیعت به صورت آزاد وجود ندارد و به طور گسترده ای با کلسیم است. عنصر استرانسیوم به شکل طبیعی در معادن به وجود می آید. منبع عمده این عنصر، دو سنگ معدن سلستیت (Celestite) و استرونسیانیت (Strontianite) می باشد. در واقع این عنصر به شکل ترکیبی با عناصر دیگر در کانی ها وجود دارد. علاوه بر آن، درصد بسیار ناچیزی (% ۰/۰۳۴) از تمامی سنگ ها و همچنین صخره های آتشفشانی را نیز به خود اختصاص می دهد. از طرفی دیگر، بعضی از سنگ های آهکی می توانند دارای مقادیر بالایی از فلز استرانسیم باشند.
لازم به ذکر است که مقدار محلول عنصر استرانسیوم در آب دریا مثل عنصر کلسیم پایین است. بنابراین بیشتر تمایل دارد که کربنات و سولفات نامحلول تشکیل دهد. خوشبختانه این عنصر به مقدار زیاد به صورت رسوبات ته نشین شده وجود دارد (به صورت سولفیت در کانی سلستیت و به صورت کربنات در کانی استرونسیانیت). در حقیقت این رسوبات ته نشین شده، راحتی در توسعه و همچنین استخراج معادن را ساده تر می کند. به عبارت دیگر می توان گفت که سلستیت یا سلستین (Celestine) از سولفات استرانسیم (با فرمول شیمیایی SrSO۴) تشکیل شده است. در حالیکه استرونسیانیت از کربنات استرانسیم (SrCO۳) تشکیل شده است. توجه داشته باشید که در طبیعت کانی سلستیت فراوان تر از کانی استرونسیانیت است. اما کانی استرونتانیت، به طور کلی مفید تر می باشد. زیرا عمده استفاده عنصر استرانسیوم به صورت کربنات است.

ذکر این نکته حائز اهمیت است که فلز استرانسیم می تواند از طریق فرآیند الکترولیز مخلوط کلر گداخته به همراه کلرید پتاسیم نیز حاصل شود. علاوه بر آن، از طریق احیای اکسید استرانسیم با آلومینیم در شرایط خلا و در واقع در دمایی که فلز استرانسیوم تقطیر می شود، نیز تولید می شود.
ویژگی های فیزیکی و شیمیایی عنصر استرانسیوم
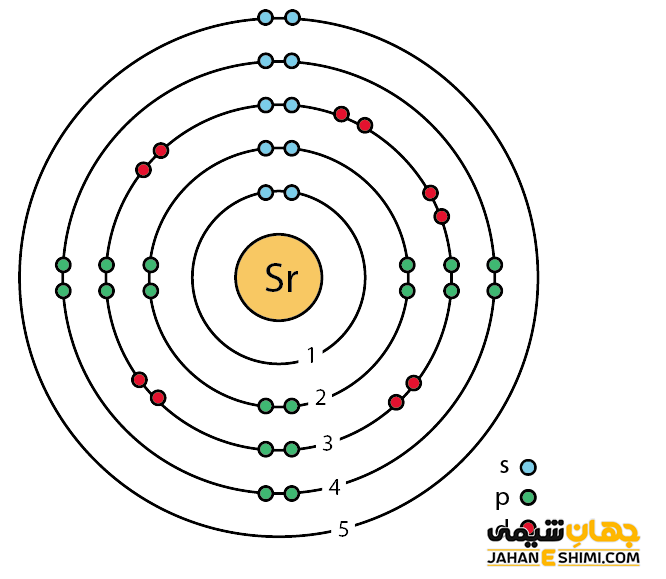
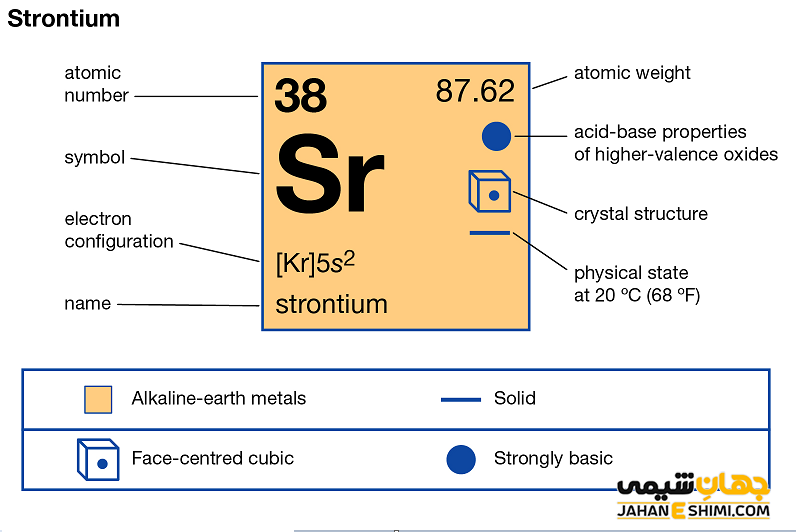
خصوصیات قابل توجه استرانسیوم از ساختار اتمی ([۳۶Kr] 5s۲) آن ناشی می شود. همانند دیگر فلزات قلیایی خاکی، دو الکترون در دورترین لایه الکترونی استرانسیوم وجود دارد. فاصله این دو الکترون تا هسته، نسبت به فاصله الکترون های نظیر در سایر فلزات قلیایی خاکی از جمله اتم های بریلیم، منیزیم و یا کلسیم بیش تر است. بنابراین این الکترون های لایه ظرفیت به آسانی جذب سایر اتم ها می شود. دقت داشته باشید که خواص فیزیکی و شیمیایی عنصر استرانسیوم شباهت زیادی به عناصر کلسیم و باریم دارد. اما این عنصر نسبت به کلسیم نرم تر است. همچنین به شدت واکنش پذیر می باشد و در آب به شدت تجزیه می شود. می توان گفت که تا حدی چکشخوار نیز می باشد.
عنصر شماره ۳۸ جدول تناوبی معمولا به رنگ سفید مایل به نقره ای یا زرد براق است. در واقع مقطع جدید آن، ظاهری نقره ای رنگ دارد. اما در هنگام مواجه با هوا به سرعت به رنگ زرد در آمده و در نتیجه اکسید می شود. دقت داشته باشید که فلز پودر شده این عنصر خیلی سریع در هوا آتش می گیرد. به عبارت دیگر، فلز نهایی در هوا می سوزد و فورا مشتعل می شود. از طرفی دیگر، نمک های فرار این فلز رنگ قرمز بسیار زیبایی دارند. از این رو، این نمک ها می توانند در فشفشه ها و مواد آتش زا کاربرد داشته باشند.

از دیگر ویژگی های عنصر شماره ۳۸ جدول تناوبی می توان به موارد زیر اشاره کرد.
- حالت فیزیکی آن در دمای ۲۵ درجه سلسیوس و فشار ۱ اتمسفر به صورت جامد است.
- دمای ذوب و دمای جوش این عنصر به ترتیب ۷۶۹ و ۱۳۸۴ درجه سانتی گراد است.
- فلز استرانسیم در هوا آتش گرفته و می سوزد.
- عنصر استرانسیوم در هوا به سرعت اکسید می شود.
- ساختار بلوری آن به شکل مکعبی وجوه پر (fcc) است.
- این عنصر ۳ آلوتروپ مختلف دارد.
- جرم اتمی استرانسیوم برابر با ۸۷.۶۲ g/mol است.
- چگالی آن نیز برابر با ۲.۶۴ g/cm۳ می باشد.
- یون های استرانسیوم معمولا عدد اکسایش برابر با اعداد +۱ و +۲ را دارند. از این جهت به عنوان اکسید بازی بسیار قوی عمل می کند. به بیان دیگر اکسید استرانسیم با آب واکنش می دهد و در نتیجه هیدروکسید استرانسیم را تولید می کند (SrO (s) + H۲O (l) → Sr(OH)۲).
- انرژی یونیزاسیون آن برابر با ۵۴۹.۵ kJ/mol است.
ایزوتوپ های عنصر استرانسیوم
همانطور که در مقالات پیشین نشریه بیان شده است، ایزوتوپ های یک عنصر، تنها در تعداد نوترون ها با هم متفاوت اند. استرانسیوم طبیعی از مخلوط چهار ایزوتوپ پایدار ۸۴Sr (0.56 %) ، ۸۱Sr (7.0 %) ، ۸۶Sr (9.86 %) و ۸۸Sr (82.58 %) تشکیل شده است. علاوه بر آن، ۱۶ ایزوتوپ ناپایدار استرانسیم نیز شناخته شده است. یکی از مهمترین ایزوتوپ های ناپایدار آن، ایزوتوپ پرتوزای استرانسیم ۹۰ (۹۰Sr) است که نیمه عمر آن برابر با ۲۹ سال می باشد. این ایزوتوپ پرتوزا در تفاله های بدست آمده از انفجار های هسته ای پیدا می شود. ۹۰Sr به شدت سمی است و مشکلاتی در سلامت انسان ایجاد می کند. زیرا به راحتی می تواند جایگزین کلسیم در استخوان های بدن شود و و اثرات مرگ آوری داشته باشد.
جالب است بدانید که تنها ایزوتوپ ۸۷Sr رادیوژنیک است. این ایزوتوپ از تجزیه فلز قلیایی و رادیواکتیو روبیدیوم بوجود آمده است. از این رو می توان گفت که تنها دو منبع برای تولید ۸۷Sr وجود دارد. این ایزوتوپ می تواند از ترکیب هسته ای عنصری با ۸۶Sr ، ۸۴Sr و ۸۸Sr شکل گیرد، یا از تجزیه رادیو اکتیو روبیدیوم ۸۷.

کاربرد های عنصر استرانسیوم
ترکیبات استرانسیوم به طور کلی دارای ارزش تجاری محدودی می باشند. زیرا ترکیبات کلسیم و یا باریم مربوطه که معمولا می توانند همان کاربرد را داشته باشند، در مقایسه با ترکیبات استرانسیم ارزان تر هستند. با این وجود، تعداد کمی کاربرد در پزشکی و داروسازی، صنایع متالورژی، صنعت ذوب فلزات، صنایع گریس سازی، صنایع سرامیک سازی، صنایع رنگ سازی و مواد رنگی، صنایع باطری های الکتریکی، فیزیک نور یا اپتیک، حمام های نمک گداخته، صابون سازی، موم، جلا دهنده ها و غیره پیدا کرده اند. از جمله آنها می توان به موارد زیر اشاره کرد :
- در صنایع نظامی؛ ترکیبات مختلف استرانسیوم همچون نیترات استرانسیم پر اکسید و اگزالات جهت ساخت منور ها، مهمات و ردیاب ها کاربرد دارند. علاوه بر آن، کربنات استرانسیوم می تواند در مهمات، تجهیزات نظامی، سیگنال های مخرب دریایی بکار رود.
- صنعت نفت؛ استرانسیوم به عنوان جایگزین باریت در گل حفاری برای چاه های نفت استفاده می شود.
- صنایع دارویی؛ در داروهای روانشناسی کاربرد دارد که باعث بالا رفتن درک مفاهیم و قدرت دریافت میگردند .
- جواهرات؛ استرانسیوم می تواند به عنوان جواهر نیز استفاده شود. اما توجه داشته باشید که فلزی بسیار نرم است و به راحتی خراش بر می دارد. همچنین کانی سلستین به دلیل رنگ آبی زیبا، مناسب کلکسیونر ها می باشد.
- ساخت تلویزیون؛ کربنات استرانسیوم برای لامپ کاتدی تصویر تلویزیون های رنگی کاربرد دارد. در واقع، مهم ترین کاربرد آن، جهت تولید شیشه های رنگی تلویزیون خواهد بود. از طرفی دیگر، از اکسید استرانسیوم و اکسید باریم جهت محافظت اشعه در شیشه های تلویزیون بهره می برند.

دیگر کاربرد های ترکیبات استرانسیوم
- با استفاده از اتم های استرانسیوم توانسته اند که دقیق ترین ساعت اتمی دنیا را توسعه دهند.
- به دلیل نمای انکساری بسیار بالای تیتانات استرانسیوم، این ترکیب در انواع جاذب های نوری کاربرد دارد. درحقیقت پراکندگی نوری آن بسیار بیشتر از الماس است.
- مک های استرانسیم برای ته نشینی ناخالصی های جزئی (مانند کمی منگنز، سیلیس و آهن) از محلول های غلیظ شده مانند سود سوز آور بکار می رود.
- کربنات استرانسیوم همچنین در وسایل هشدار دهنده آتش نشانی، فریت های سرامیکی جهت ساخت آهنربا و همچنین سرب زدایی در هنگام فرآیند تولید الکترولیتی روی استفاده می شود. علاوه بر آن، استرانسیوم در تولید آهنربا (مگنت های هیدرواکسید آهن) و تصفیه و پالایش روی نیز کاربرد دارد. این دستگاه ها در حقیقت جهت ساخت فضاپیما ها، ایستگاه های هواشناسی، بویه های دریایی و سایر جاهایی که منابع قدرت هستهای – الکتریکی، دراز مدت و سبک وزن نیاز دارند استفاده می شوند.
- نمک قرمز رنگ استرنسیم در تولید رنگ قرمز فشفشه ها، مواد آتش زا، وسایل آتش بازی، شعله های بی خطر، موشک های منور، چراغ ها، تولید لوازم الکتریکی و تهیه باتری های اتمی کاربرد دارند. این نمک ها سبب تابش درخشان در فانوس دریایی می شوند.

- نمک های استرانسیم در تصفیه شکر و چغندر قند نیز کاربرد دارند.
- جهت تهیه ابریشم مصنوعی می توان از ترکیبات استرانسیوم استفاده نمود.
- کربنات استرانسیوم همچنین برای ساخت انواع خاصی از شیشه ها بکار می رود. علاوه بر آن، فلز استرانسیم به منظور تولید شیشه های خنثی و عاری از بور برای تولید آمپول، استفاده در پزشکی و شیشه های اپتیک ویژه کاربر دارد.
- از فسفات استرانسیم می توان برای تهیه لامپ های فلوئورسانس استفاده کرد.
- از کلرید استرانسیم می توان در ساخت خمیر دندان برای دندان های حساس بهره برد.
- از اکسید استرانسیوم جهت بهبود کیفیت لعاب سفال استفاده می کنند.
ترکیبات عنصر استرانسیوم
این فلز در حقیقت یک عامل کاهنده فعال محسوب می شود. بنابراین می تواند به راحتی با هالوژن ها، اکسیژن و گوگرد واکنش دهد و هالید ها، اکسید و سولفید تولید نماید. اشکال مهم استرانسیوم عبارتند از :
- کربنات استرانسیم (SrCO۳)
- اکسید استرانسیم (SrO)
- کلرید استرانسیم (SrCl۲)
- هیدروکسید استرانسیم (Sr(OH)۲)
- سولفید استرانسیم (SrS)
- نیترات استرانسیم (Sr(NO۳)۲)
- تیتانات استرانسیم (SrTiO۳)
- کرومات استرانسیم (SrCrO۴)

خطرات استرانسیوم بر روی سلامتی انسان
ترکیباتی از استرانسیوم که در آب حل نمی شوند، در نتیجه انجام واکنش های شیمیایی می توانند به صورت محلول در آب تغییر کنند. این ترکیبات محلول در آب برای سلامتی انسان نسبت به ترکیبات نامحلول مضرتر می باشند. در حقیقت ترکیبات محلول استرانسیوم، می توانند آب آشامیدنی را آلوده کنند. اما خوشبختانه غلظت عنصر استرانسیم در آب آشامیدنی بسیار پایین است. از طرفی دیگر، دانه های خوراکی، سبزی های برگ دار و لبنیات، مقدار استرانسیوم بالایی دارند. علاوه بر آن، تنفس هوا، گرد و غبار و یا تماس با خاک آلوده به استرانسیوم نیز باعث وارد شدن مقدار کمی از این عنصر به بدن انسان می شود. دقت داشته باشید که به طور کلی، احتمال ورود استرانسیوم به بدن انسان از طریق خوردن و آشامیدن بیشتر خواهد بود.
از میان ترکیبات استرانسیوم، تنها ترکیب کرومات استرانسیم است که مقدار بسیار کم آن نیز برای سلامتی بدن مضر خواهد بود. زیرا به طور معمول، کروم سمی است و می تواند باعث بیماری شود. متاسفانه کرومات استرانسیوم باعث سرطان ریه می گردد. در کودکان جذب استرانسیوم بالا، باعث اختلالات رشد خواهد شد. لازم به ذکر است که خوشبختانه میزان استرانسیوم موجود در غذا و یا آب آشامیدنی به حدی نیست که بتواند باعث این قبیل عوارض خطرناک شود. به طور کلی می توان گفت که استرانسیوم پایدار خطری جدی برای سلامتی محسوب نمی شود. در حالیکه استرانسیوم رادیواکتیو میتواند باعث کم خونی، کمبود اکسیژن و بیماری های استخوانی همچون سرطان استخوان گردد.

طریقه نگه داری فلز استرانسیم
از آنجاییکه فلز استرانسیوم خالص با آب به شدت واکنش می دهد و همچنین می تواند به سرعت تولید آتش نماید؛ پس به راحتی خطرات آتش سوزی را به همراه دارد. از طرفی دیگر، همانطور که گفته شد این فلز در دمای اطاق خیلی سریع اکسید می شود. بنابراین برای جلوگیری از اکسیداسیون آن، باید حتما در نفت سفید نگهداری شود.



















