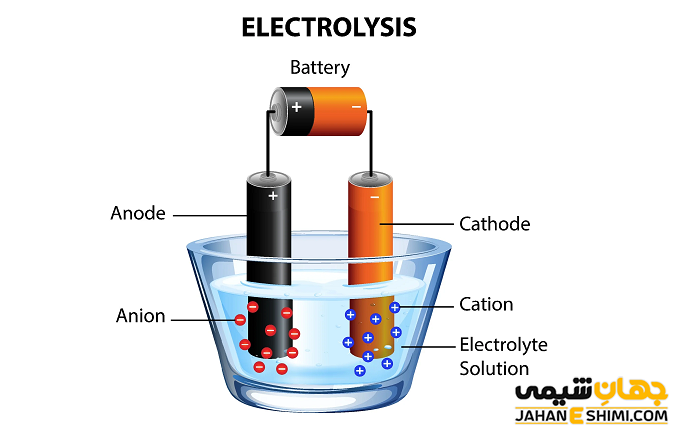
برقکافت یا الکترولیز (Electrolysis) در شیمی و صنعت، روشی جهت تبدیل مواد مختلف به عناصر سازنده خود می باشد. به عبارت دیگر، برقکافت روشی برای جداسازی عناصر و ترکیباتی است که با پیوند شیمیایی به یکدیگر متصل شده اند، بنابراین الکترولیز در صنعت کاربرد های زیادی دارد. در واقع فرآیند الکترولیز جهت انجام واکنش هایی بکار می رود که به طور خود به خودی انجام نمی شوند. لازم به ذکر است که این فرآیند در سلول های الکتروشیمیایی انجام می شود. در ادامه مقاله در نشریه جهان شیمی فیزیک به بررسی برقکافت یا الکترولیز پرداخته می شود. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- مقدمه
۲- تعریف برقکافت شیمی دوازدهم
۱-۲- اجزای سلول الکترولیتی
۲-۲- نحوه عمل سلول الکترولیتی
۳- فرآیند برقکافت
۱-۳- اکسایش و کاهش در الکترود ها
۲-۳- برقکافت آب
۳-۳- رقابت نیم واکنش ها در فرآیند الکترولیز
۴- عوامل موثر بر الکترولیز
۵- کاربرد های برقکافت
۶- مقایسه سلول های الکترولیتی و گالوانی شیمی دوازدهم
مقدمه
نخستین تحقیقات مربوط به الکترولیز، توسط سر هامفری دیوی انجام شد. وی توانست با گذراندن جریان الکتریسیته از میان محلول های آبکی، واکنش های شیمیایی را انجام دهد. علاوه بر آن، موفق به کشف شش عنصر جدید، از این طریق شد. بعد از او، شاگردش مایکل فارادی، به انجام آزمایشات کمی در این حوزه پرداخت. فارادی توانست میان مقدار بار الکتریکی، زمان واکنش برقکافت و مقدار ماده ارتباط معنا داری پیدا کند.

در واقع اگر فارادی زمان انجام واکنش را ثابت، اما شدت جریان را دو برابر می کرد، در نهایت مقدار ماده ای که در اثر الکترولیز تجزیه شده بود نیز دو برابر می شد. حال اگر با شدت جریان ثابت، زمان انجام واکنش الکترولیز را دو یا چند برابر افزایش می داد، میزان ماده ای که وارد واکنش شده بود نیز، دو یا چند برابر می شد. در نتیجه فارادی متوجه شد که میان مقدار بار الکتریکی و مقدار ماده ارتباطی به شکل مستقیم و خطی وجود دارد. لازم به ذکر است که این نتیجه گیری، مقدمه ای بر کشف الکترون شد.
تعریف برقکافت شیمی دوازدهم
همانطور که بیان شد، تجزیه یک ماده شیمیایی به عناصر سازنده اش (مثل تجزیه آب به هیدروژن و اکسیژن) به وسیله جریان الکتریسیته و در یک سلول الکترولیتی برقکافت گفته می شود. جداسازی و تجزیه با گذراندن جریان الکتریکی مستقیم یا DC و به کمک دو الکترود از میان این مواد انجام می گیرد. توجه داشته باشید که به ولتاژ مورد نیاز برای انجام برقکافت، ولتاژ تجزیه گفته می شود. از دیدگاه صنعتی و تجاری، فرآیند برقکافت یک مرحله مهم در جداسازی عناصر از منابع آنها مثل سنگ معدن یا کانسنگ می باشد. حال اگر یون ها قابلیت حرکت یا جابجایی نداشته باشند (مثل بیشتر نمک ها)، الکترولیز نمی تواند انجام شود. پس به حلال پوشی نیاز خواهد بود.
در سلول های الکترولیتی، با اعمال یک ولتاژ بیرونی و در حقیقت با عبور جریان برق از درون محلول الکترولیت مورد نظر، می توان یک واکنش شیمیایی را در جهت غیر خود به خودی و غیر طبیعی آن جلو برد. در واقع بر عکس سلول های گالوانی، از انرژی الکتریکی به انرژی شیمیایی خواهید رسید. لازم به ذکر است که عمل برقکافت نیازمند حرارت و الکتریسیته می باشد. از این رو در چندین حالت مثل دمای بالا، فشار بالا و غیره انجام می شود. مثلا برای کاهش مقدار الکتریسیته مصرفی، از مدل الکترولیز بخار (که در دمای بالا انجام می شود) استفاده می شود.
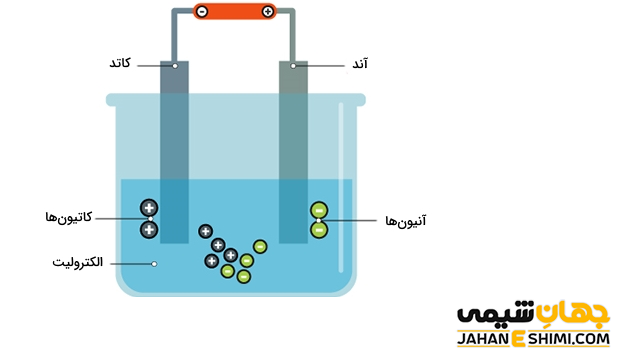
اجزای سلول الکترولیتی
- الکترولیت، یک محلول یا مذاب یونی : در حقیقت ماده مورد نظر می تواند به صورت مذاب یا حل شده در یک حلال باشد.
- منبع تغذیه برق مستقیم یا باتری : انرژی لازم جهت تولید یا شارژ یون ها از طریق منبع تغذیه تامین می شود.
- دو الکترود یا تیغه : در یک سلول الکترولیتی، الکترود شماره یک، قطب منفی سلول است که به الکترود کوتاه باتری متصل می گردد. در حالیکه الکترود شماره دو، قطب مثبت سلول است که به الکترود بلند باتری متصل شده است.
نحوه عمل سلول الکترولیتی
- با برقراری جریان الکتریسیته به وسیله منبع تغذیه میان الکترود ها، میدان الکتریکی تشکیل خواهد شد.
- یون های مثبت و منفی درون الکترولیت، به دلیل وجود میدان الکتریکی جهت گیری می کنند و به سمت قطب های نا همنام حرکت خواهند کرد.
- در این مرحله و در قطب مثبت سلول، یون های منفی محلول الکترولیت با از دست دادن الکترون، اکسید می شوند. از این رو، قطب مثبت سلول الکترولیتی آند می باشد.
- در حالیکه در قطب منفی سلول، یون های مثبت محلول الکترولیت، الکترون می گیرند و کاهش پیدا می کنند. از این رو، قطب منفی سلول الکترولیتی کاتد است.
فرآیند برقکافت
فرآیند اصلی در الکترولیز، مبادله الکترون است. در حقیقت، تبادل میان اتم ها و یون ها از طریق حذف یا گرفتن الکترون ها و به کمک یک مدار خارجی انجام می شود. یک ولتاژ الکتریکی با کمک الکترود هایی که در محلول الکترولیت قرار دارند، اعمال می شود. هر الکترود، یون های با بار غیر همنام را به سمت خود جذب می کند. یعنی در سطح الکترود منفی یا کاتد، گونه های شیمیایی الکترون می گیرند. در حالیکه بر روی سطح الکترود مثبت یا آند، گونه های شیمیایی الکترون از دست می دهند. به بیان دیگر، یون ها با بار مثبت، به سمت کاتد سلول و یون ها با بار منفی، به سمت آند سلول حرکت می کنند. توجه داشته باشید که جریان الکترون از بیرون محلول الکترولیت و به کمک مدار الکتریکی بین دو الکترود برقرار می گردد.
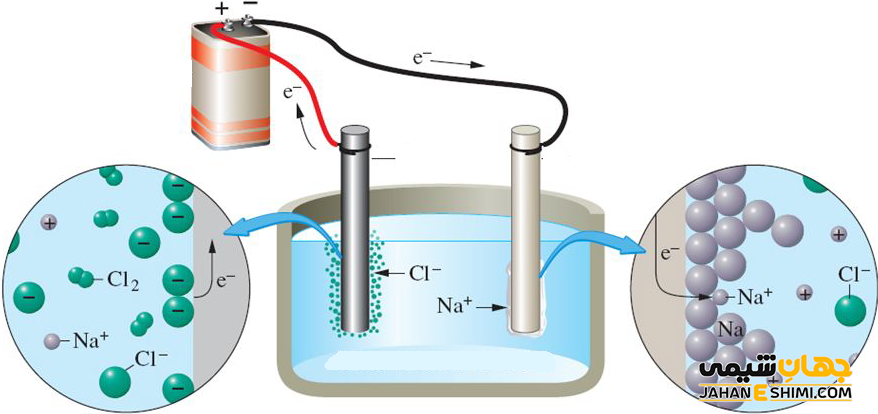
اکسایش و کاهش در الکترود ها
به فرآیندی که در کاتد صورت گرفته، کاهش یا احیا و به فرآیند که در آند رخ داده است، افزایش یا اکسایش گفته می شود. به عبارت دیگر، اکسیداسیون یون ها یا مولکلول های خنثی در آند و کاهش یون ها یا مولکلول های خنثی در کاتد اتقاق می افتد. همانطور که بیان شد، مولکلول های خنثی هم می توانند در هر دو الکترود در واکنش شرکت کنند. این مولکول ها با گرفتن یا از دست دادن الکترون باردار شده و در طول الکترولیت حرکت خواهند کرد.
برقکافت آب
الکترولیز آب فرایندی متداول جهت تجزیه آب به عناصر سازنده آن یعنی اکسیژن و هیدروژن می باشد. در فرآیند الکترولیز آب نیز واکنش های اکسایش – کاهش انجام می شود که شامل دو نیم واکنش اکسایش و کاهش به صورت زیر است. با توجه به واکنش کلی مشخص می شود که حجم گاز اکسیژن تولید شده نصف حجم گاز هیدروژن تولید شده می باشد.
نیم واکنش اکسایش:
۲H۲O (l)→ O۲ (g) + 4H+ (aq) + 4e–
نیم واکنش کاهش:
۲H۲O (l) + 2e– → H۲ (g) + 2OH– (aq)
واکنش کلی الکترولیز به شکل زیر خواهد بود :
۲H۲O (l) → ۲H۲ (g) + O۲ (g)
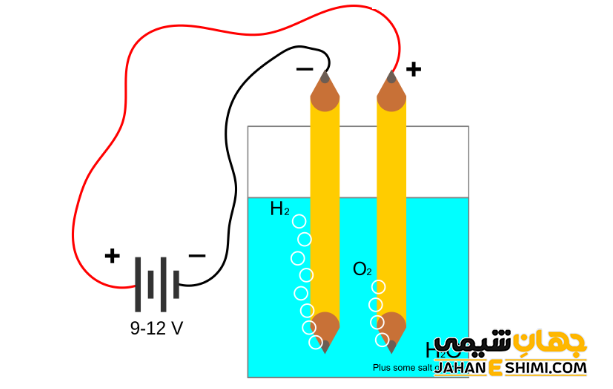
رقابت نیم واکنش ها در فرآیند الکترولیز
در سلول هایی که حاوی الکترود خنثی (مثلا جنس پلاتین) هستند، الکترولیز محلول آبی تعدادی از نمک ها منجر به کاهش کاتیون ها و افزایش آنیون ها می گردد. به عبارت دیگر، زمانیکه برخی از محلول های آبی را الکترولیز کنید، آب به جای یون های تشکیل شده از ماده حل شده، در واکنش های الکترودی شرکت می کند.
به عنوان مثال، برقکافت محلول های آبی فلزی مانند سدیم را در نظر بگیرید. در اینجا بین یون های سدیم و مولکول های آب برای گرفتن الکترون، رقابت بوجود می آید که به آن رقابت کاتدی می گویند. برنده این رقابت گونه ای خواهد بود که پتانسیل بزرگ تری داشته باشد. زیرا در این حالت، اکسنده قویتری بوده و تمایل بیشتری برای احیا خواهد داشت. در حقیقت، مولکول های آب برنده رقابت بوده و گاز هیدروژن در کاتد تشکیل می شود. یعنی به جای کاهش سدیم، آب کاهیده شده است. بدین شکل محلول اطراف الکترود، قلیایی می گردد.
حال برقکافت محلول های نمکی شامل آنیون سولفات (-SO۴۲) را در نظر بگیرید. همانطور که می دانید، آند به قطب مثبت باتری متصل است. اما از آنجاییکه در اطراف الکترود آند، مولکول های آب هم وجود دارند، پس بین یون های سولفات و مولکول های آب برای از دست دادن الکترون و اکسایش یافتن، رقابت بوجود می آید که به آن رقابت آندی می گویند. برنده این رقابت گونه ای خواهد بود که پتانسیل کوچکتری داشته باشد. زیرا در این حالت، کاهنده قویتری بوده و تمایل بیشتری برای اکسایش خواهد داشت. در حقیقت، مولکول های آب برنده رقابت بوده و کاتیون هیدروژن در آند تشکیل می شود. یعنی به جای اکسایش سولفات، آب اکسید شده است. بدین شکل محلول اطراف الکترود، اسیدی می گردد.
عوامل موثر بر الکترولیز
- ولتاژ زیاد؛ ولتاژ بالا در مواقعی اعمال می شود که بایستی بر واکنش هایی که در خود الکترود ها صورت می گیرند، غلبه کرد. این حالت بیشتر در گازها به کار می رود.
- نوع الکترود؛ در فرآیند الکترولیز، نوع الکترود نیز اهمیت دارد. الکترود خنثی فقط به عنوان محلی برای انجام واکنش عمل می کند، پس خودش در واکنش شرکت نخواهد کرد. در حالیکه الکترود فعال، بخشی از یک نیم واکنش (اکسایش یا کاهش) خواهد بود.
- واکنش های همزمان در الکترود ها؛ اگر دو نوع مختلف نیم واکنش به طور همزمان رخ دهد، باید برخی از این نیم واکنش ها از بین بروند تا جفت نیم واکنش های مناسب برای الکترولیز تعیین شوند.
- حالت واکنشدهنده ها؛ اگر واکنش دهنده های شرکت کننده در برقکافت در حالت استاندارد خود قرار نداشته باشند، از این رو، میزان ولتاژ در هر نیم واکنش با مقدار استاندارد آن متفاوت می باشد.
کاربرد های برقکافت
الکترولیز در آزمایشگاه و همچنین صنعت کاربرد های بسیار زیادی دارد. در ادامه به بررسی تعدادی از این کاربرد ها می پردازیم.
- اندازه گیری جریان الکتریکی؛ فرآیند الکترولیز یک روش مناسب جهت اندازه گیری باری است که از بخش معینی از مدار عبور کرده است. برای اینکار کافیست که جرم ماده رسوب کرده بر روی الکترود ها را در طی زمانی که فرآیند طول کشیده است، اندازه گرفت. با تقسیم جرم رسوب به زمان (در صورتیکه جریان تغییر نکرده باشد) و هم ارز الکتروشیمیایی بر طبق قوانین الکترولیز فارادی می توان جریان مدار را بدست آورد.
- کاربرد در الکترو متالورژی؛ به کمک برقکافت، فرآیند کاهش فلزات از ترکیبات فلزی و در نتیجه بدست آوردن آنها به شکلی خالص انجام می گیرد. تعدادی از فلزات قلیایی و قلیایی خاکی همچون لیتیوم، سدیم، پتاسیم، منیزیم کلسیم و یا برخی فلزات دیگر مانند مس و آلومینیوم از این طریق بدست می آیند.
- روش الکترولیتی بدست آوردن فلزات خالص؛ مثلا تولید مس الکترولیتی (مس کاتدی) از مس تصفیه شده با کیفیت کمتر. در واقع با انتخاب یک ولتاژ مناسب در الکترود های الکترولیت، می توان مطمین بود که تنها فلز مس خالص در کاتد رسوب خواهد کرد. بنابراین ناخالصی های بیگانه یا به داخل محلول حرکت می کنند (بدون رسوب کردن در کاتد) و یا در کف سلول قرار می گیرند.
- آبکاری الکتریکی؛ با استفاده از تکنیک برقکافت می توان فلزی را با لایه ای از فلزات دیگر پوشانید. به این فرآیند آبکاری الکتریکی می گویند. برای این منظور، ابتدا جسم را به صورت مکانیکی، کاملا تمیز و چربی زدایی کرده و سپس آن را به عنوان کاتد در محلول الکترولیت حاوی نمک فلزی فرو می برند. می توان به آبکاری فلزات نیکل، کروم، نقره و طلا اشاره کرد.
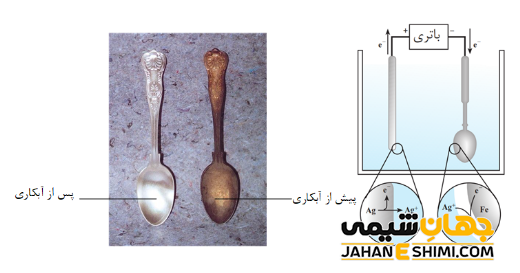
نکته
از دیگر کاربرد های الکترولیز می توان به تولید اکسیژن برای استفاده در فضاپیما ها و زیر دریایی های هسته ای و همچنین تولید سوخت هیدروژنی اشاره کرد. علاوه بر آن، تولید ترکیبات مختلفی مانند تولید کلر، سدیم هیدروکسید (NaOH)، سدیم کلرات (NaClO۳)، پتاسیم کلرات (KClO۳) و ترکیبات آلی پر فلوئوری همچون تری فلوئورو استیک اسید (CF۳CO۲HCF۳CO۲H) نیز از کاربرد های الکترولیز محسوب می شود.
آمپرسنج ها یا گالوانومتر ها را نیز می توان با بهره از مقادیر اندازه گیری شده برای هم ارزهای شیمیایی و با هر مبنای ساختمانی در دقت بالا مدرج نمود. همچنین فرآیند الکترولیز در شکل سازی الکتریکی نیز کاربرد ویژه ای دارد. در واقع قالب سازی الکتریکی کاربرد مهمی در صنعت چاپ، یعنی چاپ الکتریکی ایفا می کند.
مقایسه سلول های الکترولیتی و گالوانی شیمی دوازدهم
در سلول های گالوانی با انجام واکنش های اکسایش – کاهش در آنها انرژی الکتریکی تولید می شود. اما در سلول های الکترولیکی و با اعمال ولتاژ مناسب، یک واکنش اکسایش – کاهش دلخواه انجام می گردد. توجه داشته باشید که در هر دو سلول، نیم واکنش اکسایش در آند و نیم واکنش کاهش در کاتد انجام می شود. همچنین در هر دو سلول جهت حرکت الکترون ها در مدار بیرونی از سمت آند به سمت کاتد می باشد در جدول زیر چند تفاوت عمده این دو روش بیان شده است.
| سلول الکترولیتی | سلول گالوانی |
| انرژی الکتریکی به انرژی شیمیایی تبدیل می شود. | انرژی شیمیایی به انرژی الکتریکی تبدیل می شود. |
| در آن انرژی مصرف می شود. | در آن انرژی آزاد می شود. |
| هدف انجام یک واکنش غیر خود به خودی با صرف جریان برق می باشد. | هدف تولید جریان برق است. |
| یک واکنش غیر خود به خودی از نوع واکنش های اکسایش- کاهش انجام می گردد. | یک واکنش خود به خودی از نوع واکنش های اکسایش- کاهش انجام می گردد. |
| سطح انرژی محصولات از سطح انرژی مواد اولیه بالاتر است. | سطح انرژی محصولات از سطح انرژی مواد اولیه پایینتر است. |
| واکنش دهنده ها از پایداری بیشتری برخوردارند. | فرآورده ها از پایداری بیشتری برخوردارند. |
| آند قطب مثبت سلول و محل اکسایش، کاتد قطب منفی سلول و محل کاهش است. | آند قطب منفی سلول و محل اکسایش، کاتد قطب مثبت سلول و محل کاهش است. |
| دارای یک الکترولیت است. | دارای دو الکترولیت است. |
| دیواره متخلل دارد. | دیواره متخلل ندارد. |