معادله شیمیایی چیست؟ – موازنه و انواع واکنش های شیمیایی

وقتی یک واکنش شیمیایی را به وسیله نمادهای شیمیایی اجزای تشکیل دهنده آن و بر اساس ترکیب مواد اولیه که منجر به تشکیل محصولات می شود می نویسند، معادله شیمیایی نوشته می شود. در یک معادله شیمیایی مواد اولیه (واکنشگر) در سمت چپ معادله و مواد محصول (فرآورده) در سمت راست واکنش نوشته می شود. مواد در دو طرف واکنش به وسیله موازنه شیمیایی و با استفاده از قرار دادن اعداد پشت نمادهای شیمیایی آن ها و با استفاده از قانون بقای جرم نوشته می شوند. ارتباط مواد اولیه و محصول به وسیله یک پیکان و فلش نمایش داده می شود. به تعریف و توضیح معادلات شیمیایی در این مقاله نشریه جهان شیمی فیزیک می پردازیم.
معادله شیمیایی
معادله شیمیایی عبارتی است که می توان به وسیله نمادهای شیمیایی اجزای تشکیل دهنده یک واکنش شیمیایی، آن واکنش را نشان داد. شیمیدان فرانسوی به نام ژان بگین کسی بود که برای بار اول در سال ۱۶۱۵، یک معادله شیمیایی را بیان کرد. طبق اصل بقای جرم ماده (نه جسمی از بین می رود و نه به وجود می آید)، دو طرف یک معادله در واکنش شیمایی موازنه می شود. موازنه را با استفاده از اعدادی که به عنوان ضرایب در کنار نماد جزء شرکت کننده در واکنش نوشته می شود، نمایش می دهند. به این اعداد، ضرایب استوکیومتری گفته می شود.
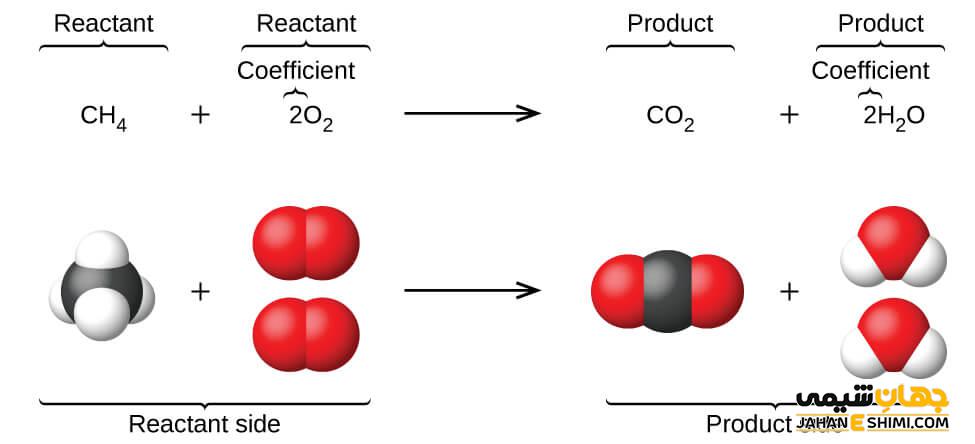
نمایش شکل کلی یک معادله شیمیایی
شکل کلی یک واکنش شیمیایی را می توان به صورت زیر نوشت.
Aa + bB → cC + dD
نمادهای شیمیایی با حروف بزرگ لاتین در این واکنش، نشان دهنده اجزای شرکت کننده در واکنش و نمادهایی که با حروف کوچک لاتین نوشته می شود، ضرایب استوکیومتری واکنش را نشان می دهند. حروف سمت چپ، اطلاعات مربوط به مواد اولیه و واکنش دهنده واکنش و حروف سمت راست هم اطلاعات مربوط به فرآورده و محصولات واکنش را نشان می دهند.
واکنش های کامل و یا تعادلی یک معادله شیمیایی
فلشی که بین نمادهای مواد اولیه و فرآورده واکنش وجود دارد، یا به شکل → نشان داده می شود که نشان دهنده واکنش یک طرفه است. به این واکنش ها، واکنش های کامل و برگشت ناپذیر می گویند که در آن ها مواد اولیه به طور کامل مصرف شده به محصول تبدیل می شود. اگر این فلش به شکل ↔ باشد نشان دهنده واکنش دو طرفه است. اگر دو فلش به شکل دو طرفه روی هم قرار گیرند، واکنش تعادلی خواهد بود. در واکنش های تعادلی غلظت مواد اولیه و محصولات در مدت زمان انجام واکنش، ثابت است. این واکنش ها برگشت پذیر هستند.
نکته
اگر در یک واکنش شیمیایی وجود نور یا انرژی برای شروع فرآیند لازم و ضروری باشد، انرژی باید در معادله آن نمایش داده شود. بدین ترتیب که اگر به وجود گرما نیاز باشد، علامت دلتا (∆) روی فلش واکنش نوشته می شود. اما اگر به وجود نور برای انجام واکنش نیاز باشد، علامت hv روی فلش نوشته می شود.
برای نشان دادن گرماده یا گرماگیر بودن واکنش نیز علامت ∆ در سمت راست یا چپ معادله نوشته می شود.
نشان دادن حالت های فیزیکی اجزای تشکیل دهنده یک واکنش شیمیایی
علایم دیگری که در ساختار یک معادله از واکنش شیمیایی وارد می شود، نمایش دهنده های حالت های فیزیکی مواد دخیل در واکنش هستند. این علایم به شکل حروف کوچک انگلسیی و داخل پرانتز در سمت راست هر جزء نوشته می شود. حالت فیزیکی جامد با (s)، حالت فیزیکی مایع با (l)، حالت فیزیکی گاز با (g) و حالت فیزیکی محلول ها با (aq) نمایش داده می شود.
انواع واکنش های شیمیایی
واکنش های شیمیایی را می توان به پنج دسته واکنش های ترکیبی، تجزیه ای، جانشینی یگانه، جانشینی دوگانه و واکنش های سوختن (احتراق) تقسیم کرد. شرط این که واکنش ها جزء کدام دسته یا دسته هایی از واکنش ها هستند، با تجریه و تحلیل مواد واکنش دهنده و فرآورده های واکنش است.
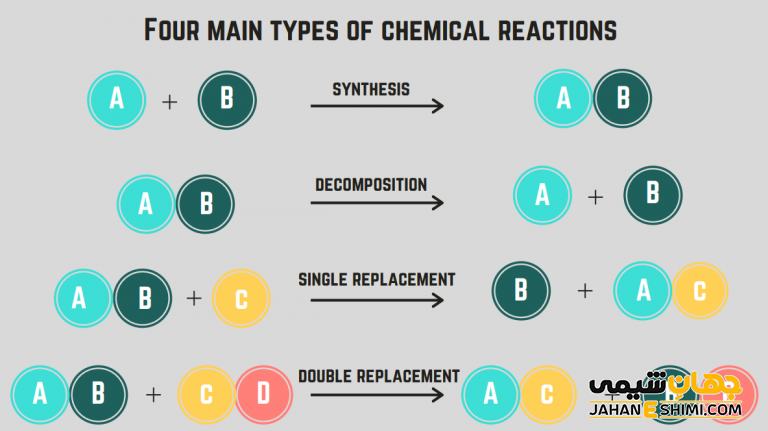
واکنش های ترکیبی
در واکنش های ترکیبی، دو یا چند ماده با هم ترکیب شده و یک ماده تک و جدیدی را به وجود می آورند. ترکیب سدیم با کلر نمونه ای از این واکنش است که باعث تشکیل نمک کلرید سدیم می شود. همچنین فلزات و نافلزات می توانند با مولکول دو اتمی اکسیژن ترکیب شده و اکسیدهای این عناصر را تشکیل دهند.
واکنش های تجزیه ای
واکنش های تجزیه ای واکنش هایی هستند که در آن ها ترکیبی به دو یا چند عنصر تجزیه و شکسته می شود. نمونه ای از این واکنش ها که به طور معمول به گرما و نور نیاز دارند، تجزیه اکسید جیوه قرمز رنگ است. از تجزیه این ترکیب، اکسیژن و جیوه به دست می آید.
واکنش های جانشینی یگانه
در واکنش های جانشینی یگانه، یک عنصر به جای عنصر مشابه در یک ترکیب در آن واکنش می نشیند. نمونه ای از آن، واکنش منیزیم با نیترات مس است. در این واکنش به دلیل فعال بودن بیشتر منیزیم از مس، این عنصر جایگزین مس می شود.
واکنش های جانشینی دوگانه
در واکنش های جایگزینی دوگانه، دو محصول جدید در یک واکنش از جایگزینی یون های مثبت و منفی در دو ترکیب از این واکنش، تشکیل می شود. این واکنش در محلول های آبی انجام می شود. یک نمونه از آن نیز واکنش یدید پتاسیم با نیترات سرب است که محصول نیترات پتاسیم و یدید سرب را به دست می دهد.
واکنش سوختن
واکنش سوختن نیز نوعی از واکنش است که در آن یک ماده با اکسیژن واکنش داده و نور و گرما آزاد می کند. در این واکنش که اکسیژن به عنوان اصلی ترین عضو شرکت کننده است، دارای انواع مختلفی است. یکی از این نمونه ها سوختن هیدروژن با اکسیژن است که بخار آب را تولید می کند. در سوختن هیدروکربن ها (مواد ساخته شده از کربن و هیدروژن)، آب و دی اکسید کربن تولید می شود. انرژی گرمایی که از این واکنش ها حاصل می شود، استفاده از هیدروکربن ها را به عنوان سوخت، مناسب کرده است.
موازنه واکنش های شیمیایی
اولین نکته ای که در نوشتن و انجام یک واکنش شیمیایی توجه کرد، موازنه آن است. این که اتم های هر نوع عنصر، در دو طرف معادله واکنش به تعداد یکسان باشند. به عنوان مثال وقتی در سمت چپ یک واکنش شیمیایی، تعداد دو اتم کربن وجود دارد، در یک معادله موازنه شده، باید تعداد اتم های کربن در سمت راست آن واکنش نیز، ۲ اتم باشد. بقیه اتم ها نیز باید به همین ترتیب در دو طرف واکنش، دارای تعداد برابری باشند.
با انتخاب ضرایب مناسب برای مواد دو طرف واکنش، موازنه واکنش انجام می شود. موازنه در واقع نشان دهنده قانون پایستگی جرم است که نشان می دهد انجام یک واکنش شیمیایی، موجب از بین رفتن مواد نمی شود. بلکه فقط در انجام یک واکنش، مواد تغییر کرده و یا حالت آن ها عوض می شود.
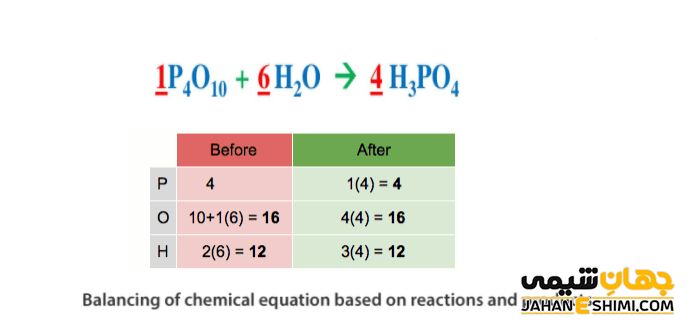
انواع روش های موازنه واکنش های شیمیایی
موازنه کردن واکنش های شیمیایی با روش های مختلفی انجام می شود. با تکرار و تمرین زیاد می توان به راحتی انواع واکنش های شیمیایی را هر چه آسان تر، موازنه کرد. پنج روش برای موازنه معادلات واکنش های شیمیایی وجود دارد. روش وارسی، جبری، تعیین پارامتر موازنه، موازنه واکنش های اکسایشی – کاهشی و موازنه به روش یون – الکترون این پنج مورد هستند.
موازنه وارسی
در روش وارسی، ابتدا با استفاده از فرمول های شیمیایی و نمادهای عناصر، معادله ی واکنش را می نویسیم. سپس با انتخاب ترکیبی که دارای بیشترین تعداد اتم ها است، موازنه را به ترتیب فلز، نافلز، اتم های هیدروژن و سپس اتم های اکسیژن در دو طرف معادله واکنش انجام می دهیم. برای انتخاب بهترین عدد به عنوان ضریب استوکیومتری، باید توجه کرد که کوچکترین عدد صحیح و غیر کسری باشد.
موازنه جمع جبری
در این روش ابتدا ضرایب a، b، c و … را به هر جزء واکنش نسبت می دهیم. سپس با استفاده از ضرایب و تشکیل معادله، تعداد اتم های هر عنصر را به دست آورده و بین ضرایب رابطه ای را به دست می آوریم. با نسبت دادن عددی مثل یک به بالاترین ضریب، با به کار بردن عددها می توان موازنه را انجام داد.
موازنه تعیین پارامتر موازنه
برای این روش ابتدا برای ترکیبی که بیشترین تعداد اتم را دارد، ضریب یک را در نظر گرفته و یک ضریب مناسب برای عنصری از این ترکیب در نظر می گیریم که این عنصر فقط در یک عنصر دیگر وجود داشته باشد. سپس ضریب X را برای پیچیده ترین ترکیب انتخاب کرده و ضرایب دیگر را برای ترکیبات دیگر انتخاب می کنیم. با توجه به قانون پایستگی جرم می توان ضرایب را بر حسب X برای عناصر دیگر که در یک ماده وجود دارند، به دست آورد. مقدار X را با استفاده از عنصری که موازنه نشده، به دست می آورند.
موازنه واکنش های اکسایشی – کاهشی
تغییر عدد اکسایش، ملاک موازنه واکنش های اکسایشی – کاهشی است. یعنی ابتدا تغییر عدد اکسایش عناصر اکسید و یا کاهیده شده را به دست آورده و در عددی که به جزء یک باشد و در قسمت زیروندی سمت چپ عنصر باشد، ضرب می شود. تغییر عدد اکسایش که در زیروند هم ضرب شده باشد و مربوط به ماده اکسید شده باشد، به عنوان ضریب ماده کاهش یافته قرار می گیرد. تغییر عدد اکسایش ماده کاهش یافته نیز به عنوان ضریب ماده اکسید شده قرار می گیرد. حال با توجه به دو ضریب استوکیومتری به دست آمده، عناصر دیگر در دو طرف معادله واکنش، موازنه می شوند.
موازنه به روش یون – الکترون (نیمه پیلی)
این روش موازنه برای دو دسته از محلول های اسیدی و بازی به طور جداگانه انجام می شود. در این روش معادله واکنش های یونی به صورت دو نیم واکنش نوشته می شود. در این نیم واکنش ها با توجه به نیاز اکسیژن و هیدروژن در محلول های مختلف اسیدی و بازی، به دو طرف می توان یون هیدروکسید و مولکول آب را اضافه کرد. با موازنه نیم واکنش ها آن را به واکنش کلی نسبت می دهیم.



















