آشنایی با زندگی نامه و دستاورد های علمی یوهان دیدریک وان در والس

یوهان دیدریک وان در والس از دانشمندان برجسته هلندی است که دستاورد های علمی گران بهایی در زمینه فیزیک و ترمودینایک دارد. از مهم ترین دستاورد های او می توان به معادله واندروالس، نیروی واندروالسی، شعاع واندروالسی و … اشاره کرد.
به دنبال نظریات و ابداعات این دانشمند بود که توانستند هلیم و هیدروژن را به مایع تبدیل کنند. وان در والس توانست در سال ۱۹۱۰ جایزه نوبل فیزیک را کسب کند. در این مقاله از نشریه علمی جهان شیمی به زندگی نامه و توضیح دستاورد های او می پردازیم.
زندگی نامه یوهان دیدریک وان در والس
یوهان دیدریک وان در والس (Johannes Diderik van der Waals) فیزیکدان و ترمودینامیکدان هلندی است که در ۲۳ نوامبر ۱۸۳۷درلیدن هلند متولد شد. او در یک خانواده پر جمعیت متولد شد و پدرش نجار بود.
به خاطر ساختار تحصیلی خاص قرن نوزدهم تصمیم گرفت پس از اتمام تحصیلات در دوره های ابتدایی به جای ورود به دوره دبیرستان که پیش نیاز ورود به دانشگاه بود تصمیم گرفت تا وارد مدرسه تحصیلات پیشرفته شود. در این مدارس معلمان دوره ابتدایی را پرورش می دادند.
یوهان توانست این دوره را در ۱۵ سالگی به پایان رسانده و بهعنوان معلم دوره ابتدایی طی سالهای ۱۸۵۶ تا ۱۸۶۱ به تدریس بپردازد. پس از آن دوره های تکمیلی را سپری کرد و به عنوان معلم ارشد در مدرسه مشغول به تدریس شد.
در سال ۱۸۶۲ به خاطر علاقهای که به درس های ریاضیات، فیزیک و ستاره شناسی داشت در کلاس های این دروس در دانشگاه محل تولدش شرکت می کرد. اما، دانشگاه اجازه تحصیل رسمی را به وی نمی داد. زیرا، وی دوره دبیرستان را سپری نکرده بود.
ورود وان در والس به داشگاه لیدن

در این دوران بود که دولت هلند شروع به برگزاری دوره هایی تحصیلی در دوره دبیرستان برای کسانی مانند یوهان وان در والس کرد. یوهان برای تدریس ریاضیات در این مدارس، درخواست داد و مورد پذیرش واقع شد. او به صورت هم زمان به مطالعه سایر دروس نیز پرداخت.
یوهان در امتحانات پایان سال شرکت کرد تا بتواند مقطع دبیرستان را به پایان برساند و اجازه ورود به دانشگاه را کسب کند. بعد از پایان این دوره بود که یوهان شروع به تحصیل در دانشگاه لیدن در محل تولدش کرد و تحصیلاتش را در رشته فیزیک تا مقطع دکترا ادامه داد.
او در سال ۱۸۷۳ توانست از پایان نامه دکترای خود دفاع کند. وان در والس در سال ۱۸۷۷ عضو هیئت علمی دانشگاه آمستردام شد. وی در سال ۱۹۱۰ بهخاطر ارائه معادله حالت گازها و مایعات موفق به دریافت جایزه فیزیک نوبل شد. این دانشمند برجسته هلندی در تاریخ ۸ مارس سال ۱۹۲۳ و در ۸۵ سالگی در شهر آمستردام هلند درگذشت.
دستاورد های علمی یوهان دیدریک وان در والس
دستاورد های این فیزیکدان در حوزه ترمودینامیک بسیار ارزشمند است. به همین منظور جایزه نوبل فیزیک در سال ۱۹۱۰ به وی اهدا شد. از دیگر دستاورد های مهم یوهان وان در والس می توان به نیروی واندروالسی و معادله واندروالس اشاره کرد.
این معادله نشان می دهد چون مولکول های موجود در یک گاز دارای حجمی معین هستند و نیروهای جاذبه بر یکدیگر وارد می کنند، گازهای حقیقی از قانون گاز های ایدهآل پیروی نمی کنند.
او در سال ۱۸۷۳ وجود نیرو های کشش بین مولکولی در میان مولکول های گاز را مطرح کرد. به نظر وی مجموع این نیرو ها مقدار انحراف یک گاز حقیقی از گاز ایدهآل را تعیین می کنند. توضیح خاستگاه این نیروهای بین مولکولی، در سال۱۹۳۰ توسط فریتز لاندن پیشنهاد شد.
در فیزیک، شعاع های واندروالس نشان دهنده ی کوتاه ترین فاصله ممکن بین اتم هایی است که بین آن ها پیوند شیمیایی وجود ندارد. این فاصله مقداری است که در آن، نیرو های جاذبه ضعیف موجود بین اتم ها، با نیروی دافعه بین لایه های الکترونی، به تعادل می رسند.

به این ترتیب، یوهان وان در والس برای نخستین بار ایده شعاع های وان در والس را مطرح کرد. به عقیده ی او اتم ها یک نقطه ساده نیستند و همین ایده را در معادله واندروالس نشان داد.
علاوه بر این، او دو ثابت جدید به ربایش بین مولکولی و به حجم خود مولکول ها به معادله گازها اضافه کرد. در پی ابداعات او بود که دانشمندان توانستند هیدروژن و هلیوم را به مایع تبدیل کنند.
نیروهای واندروالسی
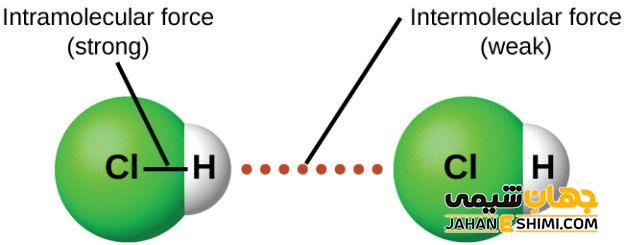
همه اتم های موجود در مولکول ها، توسط پیوند های کووالانسی کنار یکدیگر نگه داشته می شوند. اما پرسشی که مطرح می شود این است که، مولکول ها در حالت مایع و جامد توسط چه نیروهایی به سمت یکدیگر جذب می شوند؟ نیروهایی که مولکول های یک ماده را در حالت مایع یا جامد به یکدیگر وصل می کند به نیرو های بین مولکولی معروف است.
نیرو های بین مولکولی موجود بین مولکول های قطبی با نیرو های بین مولکولی بین مولکول های غیر قطبی متفاوت است. معمولا نیرو های بین مولکولی به نام نیرو های واندروالسی معروف هستند. وجود این نیرو ها در بین مولکول ها موجب می شود که یک ترکیب جامد مولکولی، شکل معینی داشته و با غلبه بر این نیرو ها بتوان آن را به حالت مایع درآورد.
نکته
امروزه نیرو های بین مولکولی، به صورت عام به نیرو های واندروالس و نیرو های پراکندگی بین مولکول های غیر قطبی به نیروهای لاندن معروف هستند.
انواع نیروهای واندروالسی
نیروهای بین مولکولی به چهار گروه دسته بندی می شوند.
- دوقطبی – دوقطبی
- دوقطبی – دوقطبی القایی
- لاندون (پراکندگی)
- پیوند هیدروژنی
نیروی دو قطبی – دو قطبی
این نیروها بین مولکول های قطبی دیده می شوند. این مولکول ها دارای دو قطبی های دائمی هستند و مایل هستند در راستای میدان الکتریکی قرار بگیرند.
پایدارترین حالت این نیرو زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکول های مجاور، یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی به وجود می آید.
با توجه به مقادیر الکترونگاتیوی اتم ها در یک مولکول دو اتمی، می توان میزان قطبیت مولکول و جهت گیری قطب های مثبت و منفی را پیش بینی کرد. پیش بینی قطبیت مولکول های چند اتمی مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترون های غیرمشترک است.
پیوند هیدروژنی
نوعی نیروی بین مولکولی است که در آن بین اتم هیدروژن (H) از یک مولکول با اتم های الکترونگاتیو مانند فلوئور (F)، اکسیژن (O) و نیتروژن (N) از مولکول های دیگر، جاذبه به وجود می آید. ز این رو، به پیوند هیدروژنی معروف است.
پیوند هیدروژنی بین ترکیبات دارای اتم های اکسیژن، فلوئور، نیتروژن و هیدروژن وجود دارد. در این ترکیبات به دلیل اختلاف الکترونگاتیوی و توزیع نامساوی الکترون روی اتم ها، هیدروژن دارای مقدار جزئی بار مثبت و اتم الکترونگاتیوتر دارای مقدار جزئی بار منفی می شود.
در این نوع پیوند، هیدروژن به عنوان پلی بین دو اتم الکترونگاتیو عمل می کند. این پیوندها می توانند بین ملکول های مختلف و یا بین اتم های مختلف یک مولکول تشکیل شوند. گفته می شود انرژی لازم برای شکستن یک مول پیوند هیدروژنی از حدود ۱ تا ۱۰ کیلوکالری متغیر است.
نکته
اگرچه پیوندهای هیدروژنی از پیوندهای کووالانسی ضعیف تر است، اما در میان نیرو های بین مولکولی قوی ترین آن ها به شمار می رود. این پیوند ها نقش مهمی در ساختار مواد مهم زیستی (بیولوژیکی) دارای پیوندهای N – H و O – H و تعیین خواص آن ها دارد.
شکل هندسی پروتئینها و اسیدهای نوکلئیک که ترکیب های آلی دارای زنجیر بلند هستند تحت تاثیر پیوند هیدروژنی میان گروه های N – H یک زنجیر و گروه C = O زنجیر مجاور است. در ربایش فضای بین مولکولی اتم های هیدروژن، پیوند واندروالسی به طور چشم گیری افزایش می یابد.
نیروی لاندن
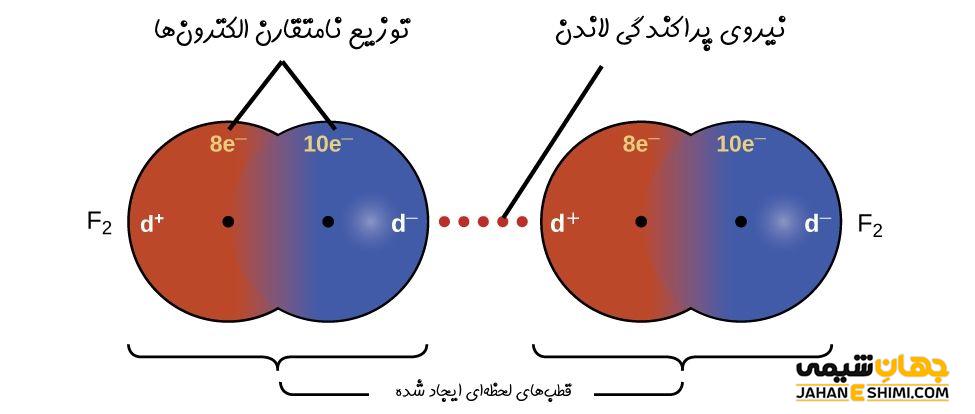
از جمله نیرو های بین مولکولی ضعیف است که در آن نوعی جاذبه میان مولکول های ناقطبی وجود دارد. در مولکول های ناقطبی در اثر برهم خوردن توزیع الکترون، مولکول های دوقطبی لحظهای یا دوقطبی القایی ایجاد می شود.
مولکول های غیرقطبی، دوقطبی دائمی ندارند. ولی با این وجود می توان تمام مواد غیرقطبی را به مایع تبدیل کرد. به این ترتیب، علاوه بر نیروی مولکول های دوقطبی-دوقطبی، باید نوع دیگری از نیروی بین مولکولی وجود داشته باشد.
وجود نیرو های پراکندگی در مولکول ها به عنوان یک اصل مورد پذیرش است. تصور می شود این نیروها ناشی از حرکت الکترونها است. به این صورت که در یک لحظه از زمان، ابر الکترونی یک مولکول به نحوی تغییرشکل میدهد که یک دوقطبی لحظهای به وجود می آید.
به این ترتیب در قسمتی از مولکول به مقدار بسیار کم بار منفی تر از قسمت های دیگر ایجاد شده و در لحظه بعد به علت حرکت الکترون ها جهت دوقطبی لحظهای تغییر می کند.
اثرگذاری این دوقطبی های لحظهای موجب می شود مولکول های غیرقطبی فاقد دوقطبی دائمی شوند. به مین دلیل، دوقطبی های مواج لحظه ای یک مولکول، دوقطبی های نظیر خود را در مولکول های مجاور جذب می کنند.
حرکت هم زمان الکترون های مولکول های مجاور موجب ایجاد نیروی جاذبه بین این دو قطبیهای لحظهای شده و نیروی لاندن را تشکیل می دهند. نیروی لاندن بین مولکول های قطبی هم دیده می شود. به عنوان مثال در آب ۸۰ درصد پیوند هیدروژنی و ۲۰ درصد نیروی لاندن وجود دارد. اما تنها نیروی بین مولکولی موجود در مولکول های غیرقطبی، نیروی لاندن است.
شعاع واندروالسی
شعاع واندروالسی نمایانگر کوتاه ترین فاصله ممکن بین اتم هایی است که بین آن ها پیوند شیمیایی وجود ندارد. در این فاصله، نیرو های جاذبه ضعیف بین اتم ها با نیروی دافعه بین پوسته های الکترونی، به تعادل می رسند.
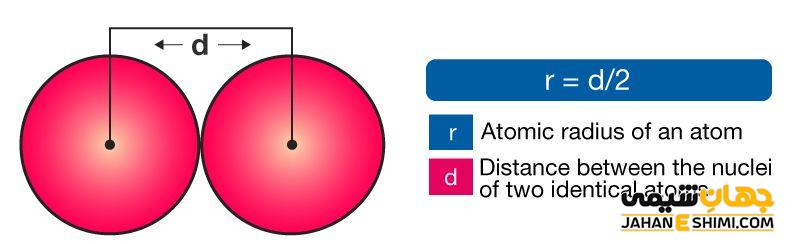
انواع شعاع اتمی
- شعاع اتمی
- شعاع یونی
- کووالانسی
- فلزی
- واندروالسی
معادله واندروالس
از آن جایی که مولکول های موجود در یک گاز، دارای حجمی معین هستند و به یکدیگر نیرو های جاذبه وارد می سازند، گازهای حقیقی از قانون گاز های ایدهآل پیروی نمی کنند. اثرهای مربوط به گازهای حقیقی به وسیله وان در والس در معادله حالت او گنجانیده شده است.
(p + n۲a/v۲) (v – nb) = n R T
در معادله فوق، ضرایب a و b ثابت های مشخص گاز مورد نظر هستند. a معیاری برای جاذبهٔ بین مولکول ها و b حجم میانگین اشغال شده از V توسط مولکول ها و داری مقداری در حدود چهار برابر حجم واقعی مولکول ها است. عبارت
(a/v۲)
کاهش فشار ناشی از نیرو های جاذبه بین مولکولی از مقدار ایدهآل آن است. این معادله به افتخار کاشف آن، معادله وان در والس نامیده می شود.



















