فرمول مولکولی چیست و چگونه تعیین می شود؟

فرمول مولکولی (Molecular formula) تعداد دقیق و نوع اتم ها در یک مولکول واحد از یک ترکیب شیمیایی را توصیف می کند.
عناصر تشکیل دهنده توسط نمادهای شیمیایی نشان داده می شود و تعداد اتم های هر عنصر موجود در هر مولکول به عنوان یک زیرنویس زیر نماد آن عنصر نشان داده می شود. Molecular formula با استفاده از یک خط واحد از نمادها و اعداد عناصر شیمیایی ، اطلاعاتی را در مورد نسبت اتمهایی که یک ترکیب شیمیایی خاص را تشکیل می دهند ، بیان می کند. البته بعضی اوقات شامل نمادهای دیگری مانند پرانتز ، خط تیره و علامت های مثبت (+) و منهای (-) نیز می شود.
برای ترکیبات آلی ، کربن و هیدروژن اولین عناصر ذکر شده در این فرمول هستند و عناصر باقیمانده به ترتیب حروف الفبا بیان می شوند. به عنوان مثال ، برای بوتان ، فرمول مولکولی C۴H۱۰ است . برای ترکیبات یونی ، کاتیون مقدم بر آنیون در این فرمول قید می شود مانند سدیم فلوراید NaF است.
Molecular formula نام شیمیایی نیست و حاوی هیچ کلمه ای نیست. اگرچه ممکن است حاکی از ساختارهای شیمیایی خاصی باشد ، اما با فرمول ساختار شیمیایی کامل یکسان نمی باشد. در واقع فرمول های مولکولی محدودتر از نام های شیمیایی و فرمول های ساختاری هستند. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
روش نوشتن فرمول مولکولی
فرم متداول برای نوشتن Molecular formula نوشتن علامت برای هر عنصر و به دنبال آن یک زیر نویس است که تعداد واقعی آن اتم ها را در یک مولکول نشان می دهد. وقتی فقط یک اتم از یک عنصر وجود داشته باشد ، زیرنویس حذف می شود. به عنوان مثال Molecular formula آب ، H۲O ، مشخص می کند که در هر مولکول آب دو اتم هیدروژن و یک اتم اکسیژن وجود دارد.
به ساده ترین نوع فرمول های شیمیایی فرمول های تجربی گفته می شود که نسبت هر عنصر در مولکول را نشان می دهد. فرمول تجربی ساده ترین نسبت تعداد کل اتم های یک مولکول است.
به عنوان مثال:
Molecular formula گلوکز (قندی که در بسیاری از واکنش های بیولوژیکی مهم است) ، C۶H۱۲O۶ می باشد که مشخص می کند که در هر مولکول گلوکز ۶ اتم کربن ، ۱۲ اتم هیدروژن و ۶ اتم اکسیژن وجود دارد. در مقابل ، فرمول تجربی گلوکز ، CH۲O است که فقط مشخص می کند برای هر اتم کربن دو اتم هیدروژن و یک اتم اکسیژن وجود دارد. اگر با مولهای گلوکز سروکار داشته باشید ، فرمول تجربی گلوکز CH۲O فقط مشخص می کند که برای هر مول اتم کربن دو مول اتم هیدروژن و برای هر مول اتم کربن یک مول اتم اکسیژن وجود دارد.
بنابراین برای نوشتن Molecular formula اطلاعات بیشتری نسبت به ساخت فرمول تجربی یک ماده مورد نیاز است . فرمول تجربی را می توان از تجزیه و تحلیل بنیادی یک ماده بدست آورد. برای بدست آوردن فرمول مولکولی ، باید کل توده مولکولی به صورت آزمایشی تعیین شود. پس این فرمول با توجه به فرمول تجربی و جرم مولکولی یک ماده تعیین می شود.

روش تعیین فرمول مولکولی
Molecular formula یک ترکیب همیشه یک عدد صحیح (مثل ۱ ، ۲ ، ۳ ، …) از فرمول تجربی آن می باشد. اگر فرمول تجربی یک ترکیب شناخته شده باشد ، می توان آن را با اندازه گیری تجربی وزن مولکولی ترکیب تعیین کرد هنگامی که وزن مولکولی یک ترکیب به طور آزمایشی تعیین شد ، دو مرحله برای تعیین این فرمول وجود دارد.
اولین مرحله تقسیم وزن مولکولی تعیین شده بر وزن مولکولی فرمول تجربی به منظور تعیین عدد صحیح است که نشان دهنده تعداد واحدهای فرمول تجربی در Molecular formula است. در مرحله دوم ، این فرمول با ضرب زیرنویس های فرمول تجربی در ضرب انتگرال واحدهای فرمول تجربی بدست می آید.
به عنوان مثال ، کربوهیدرات ها یا ساکاریدهای زیادی وجود دارند که دارای فرمول تجربی CH۲O بوده و دارای یک Molecular formula هستند که یک عدد صحیح از CH۲O است به طوری که می توانند به عنوان یک گروه به طور کلی با فرمول توصیف n (CH ۲O) شوند که n یک عدد صحیح است که تعداد واحدهای فرمول تجربی را در فرمول مولکولی کربوهیدرات نشان می دهد.
نکته: اگر وزن مولکولی یک کربوهیدرات (قندهای ساده) با فرمول تجربی CH۲O به طور تجربی با استفاده از تجزیه و تحلیل افتراقی ۱۸۰ گرم در مول باشد ، با تقسیم وزن مولکولی آزمایش شده ، یک عدد صحیح از شش (۶) بدست می آید. ۱۸۰ گرم در مول بر ۳۰ گرم در مول (وزن تئوری واحد فرمول تجربی) تقسیم شده است. این بدان معنی است که ۶ فرمول تجربی در Molecular formula وجود دارد. وقتی مشتقات فرمول تجربی در عدد شش (۶) ضرب می شوند فرمول مولکولی گلوکز (C۶H۱۲O۶ ) بدست می آید.
در مقابل ، اگر همه زیرنویس های آن بر يك مخرج مشترك قابل تقسيم باشد ، این فرمول به یک فرمول ساده يا تجربی قابل كاهش است. به عنوان مثال ، نیکوتین دارای فرمول مولکولی C۱۰H۱۴N۲ است که می توان با تقسیم آن فرمول تجربی N5H7 را بدست آورد.
سایر روش های تعیین فرمول مولکولی
برای تعیین Molecular formula ( یعنی تعداد واقعی اتمهایی که در یک مولکول وجود دارد) می توان از برخی روشهای تجربی استفاده کرد. به عنوان مثال اشعه ایکس می تواند در تعیین واقعی تعداد اتم ها در برخی از جامدات استفاده شود.
ترکیباتی وجود دارند که فرمول تجربی و مولکولی یکسانی دارند. به عنوان مثال ، متان CH ۴ فرمول تجربی و مولکولی یکسانی دارد. ساده ترین نسبت تعداد کل هیدروژن به اتم کربن، چهار اتم هیدروژن به ازاء هر اتم کربن است. از آنجاییکه CH ۴ فرمول مولکولی هم هست این مسئله مشخص می کند که در یک مولکول متان، چهار اتم هیدروژن به یک اتم کربن پیوند دارد.
ترکیبات نیز ممکن است دارای فرمول تجربی یکسانی باشند اما به طور چشمگیری در فرمولهای مولکولی متفاوت هستند. به عنوان مثال ، استیلن و بنزن هر دو فرمول تجربی CH دارند. فرمول مولکولی استیلن C۲H۲ و برای بنزن C۶H۶ است.
بهتر است بدانید:
برخی از مواد در واقع به عنوان مولکول های جدا شده وجود ندارند بنابراین ارائه فرمولهای مولکولی برای چنین موادی از نظر فنی غیرممکن است. به عنوان مثال ، نمک خوراکی (NaCl) به عنوان یک ماده مولکولی وجود ندارد بلکه به عنوان یک شبکه بلوری پیوند یافته یونی وجود دارد.
صرف نظر از این ، اصطلاحات فرمول و جرم مولکولی اغلب به طور اتفاقی (اما اکنون به اشتباه) بر روی این مواد یونی اعمال می شود. دلیل این سردرگمی در اصطلاحات این است که اصطلاح مولکول در اصل به عنوان مجموعه ای از اتمهای پیوند یافته (توسط پیوندهای یونی یا کووالانسی) به هم پیوسته به اندازه کافی نزدیک تعریف شده است تا به عنوان یک ساختار فیزیکی پیوسته در نظر گرفته شود. در این راستا ، یک مولکول به عنوان یک واحد یا کوچکترین ذره ترکیبی در نظر گرفته شده که خصوصیات شیمیایی ماده را حفظ می کند.
با این حال ، ترکیبات یونی از یون ها تشکیل شده اند و از اتم های دارای پیوند کووالانسی برخوردار نیستند. برای ترکیبات یونی باید از جرم فرمول به جای جرم مولکولی و فرمول تجربی استفاده کرد.
مواد می توانند مولکولی (با پیوندهای کووالانسی به هم متصل شوند) یا یونی (همراه با جاذبه الکتریکی یونی) باشند. مواد مولکولی با استفاده از فرمول مولکولی آنها (به عنوان مثال، H2O یاCH 4 ) و ترکیب یونی توسط واحد فرمول (به عنوان مثال، نمک طعام و یا MGF ) نمایش داده می شوند.
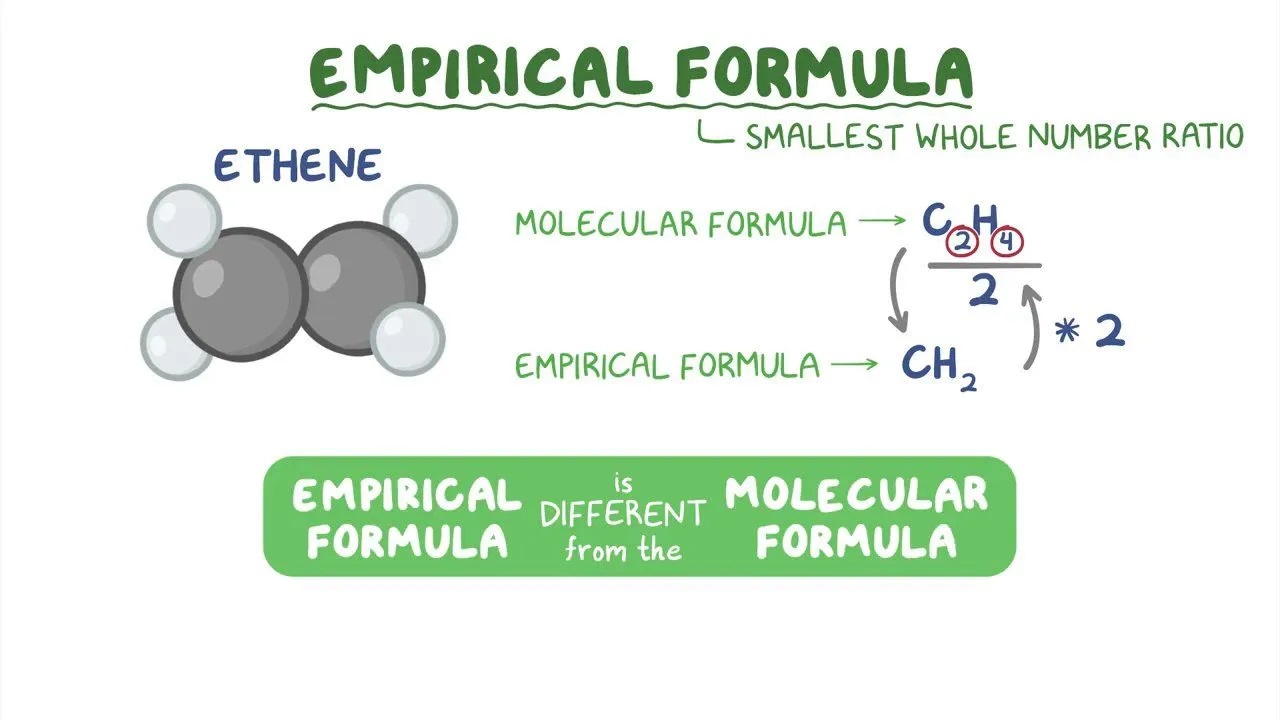
تفاوت فرمول های ساختاری و مولکولی
فرمولهای مولکولی هیچ اطلاعاتی در مورد آرایش اتم ها نشان نمی دهد. به همین دلیل Molecular formula می تواند تعدادی از ساختارهای مختلف شیمیایی را توصیف کند. از فرمول ساختاری برای نشان دادن نه تنها تعداد اتم ها ، بلکه همچنین ترتیب آنها در فضا استفاده می شود. ترکیباتی که دارای یک فرمول شیمیایی هستند اما ساختار شیمیایی متفاوتی دارند به عنوان ایزومر شناخته می شوند و می توانند خصوصیات فیزیکی کاملاً متفاوتی داشته باشند.
مانند Molecular formula فرمول ساختاری یک ماده تعداد دقیق اتم های هر عنصر در هر مولکول را نشان می دهد. علاوه با این وجود فرمول ساختاری نحوه پیوند اتم ها به یکدیگر را نیز نشان می دهد. در نتیجه ، فرمول ساختاری برای تعیین شکل مولکول و خصوصیات مرتبط با آرایش های خاص هندسی مولکولی ضروری است.
همانطور که موادی با فرمول تجربی یکسان وجود دارند که در Molecular formula متفاوت هستند ، موادی نیز وجود دارند که فرمول تجربی و مولکولی یکسانی دارند و فقط با استفاده از فرمول ساختاری قابل تفکیک هستند.
تعیین ترکیب درصد فرمول مولکولی
فرمولهای تجربی را می توان از طریق درصد ترکیب تعیین کرد. برای تعیین Molecular formula آن ، دانستن جرم مولی این ترکیب ضروری است. شیمی دانان از ابزاری به نام طیف سنج جرمی برای تعیین جرم مولی ترکیبات استفاده می کنند. برای رفتن از فرمول تجربی به مولکولی ، این مراحل را دنبال کنید:
- جرم فرمول تجربی (EFM) را محاسبه کنید ، که به سادگی جرم مولی است که با فرمول تجربی نشان داده می شود.
- جرم مولی ترکیب را بر روی جرم فرمول تجربی تقسیم کنید. نتیجه باید یک عدد کامل یا بسیار نزدیک به یک عدد کامل باشد.
- تمام زیرنویس های موجود در فرمول تجربی را در كل اعداد موجود در مرحله ۲ ضرب كنيد.
به عنوان مثال: فرمول مولکولی ترکیبی که دارای جرم مولکولی ۳۴ گرم در مول و فرمول تجربی HO باشد چیست؟ جرم فرمول تجربی را محاسبه کنید.
شما با یافتن جرم HO (1 اتم هیدروژن و ۱ اتم اکسیژن) این عدد را تعیین می کنید.
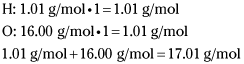
بنابراین جرم فرمول تجربی برابر است با ۱۷.۰۱ g/mol
در مرحله بعدی جرم مولکولی را به جرم فرمول تجربی تقسیم کنید.
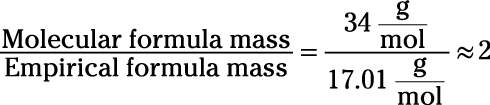
یک از زیرنویس های فرمول تجربی را در عدد محاسبه شده در مرحله ۲ ضرب کنید. ضرب زیرنویس ها در فرمول تجربی در این عدد فرمول مولکولی H2O2 را به شما می دهد. این فرمول مربوط به ترکیب پراکسید هیدروژن است.
فرمول مولکولی چیست شیمی دهم
فرمول مولکولی یک ترکیب نشان دهنده تعداد دقیق هر نوع اتم موجود در یک مولکول است. با استفاده از نمادهای شیمیایی برای عناصر درگیر، همراه با زیرنویس های عددی برای نشان دادن نسبت اتم ها نشان داده می شود. به عنوان مثال، فرمول مولکولی آب H2O است که نشان می دهد هر مولکول آب دارای دو اتم هیدروژن و یک اتم اکسیژن است. یافتن فرمول مولکولی یک ترکیب شامل چندین مرحله است، از جمله:
فرمول تجربی را تعیین کنید: فرمول تجربی ساده ترین نسبت عدد کامل اتم ها را در یک ترکیب نشان می دهد. می توان آن را بر اساس داده های تجربی مانند ترکیب درصد جرمی یا تجزیه و تحلیل عنصری تعیین کرد. هنگامی که فرمول تجربی شناخته شد، به عنوان نقطه شروع برای یافتن فرمول مولکولی عمل می کند.
محاسبه جرم مولی: جرم مولی یک ترکیب، مجموع جرم اتمی تمام اتم های موجود در یک مول از ترکیب است. برای محاسبه جرم مولی، جرم اتمی هر عنصر را در تعداد اتم های موجود در فرمول تجربی ضرب کنید، سپس نتایج را جمع کنید.
جرم مولکولی را تعیین کنید: جرم مولکولی یک ترکیب، جرم واقعی یک مولکول ترکیب است. برابر است با جرم مولی ترکیب که بر حسب گرم بر مول بیان می شود. این مقدار را می توان به صورت تجربی با استفاده از تکنیک هایی مانند طیف سنجی جرمی تعیین کرد یا بر اساس ساختار شیمیایی ترکیب محاسبه کرد.
فرمول مولکولی را پیدا کنید: برای یافتن فرمول مولکولی از فرمول تجربی، جرم مولکولی ترکیب را بر جرم مولی فرمول تجربی تقسیم کنید. این نسبت تعداد واحدهای فرمول تجربی موجود در یک مولکول ترکیب را نشان می دهد. اگر نتیجه یک عدد کامل باشد، فرمول تجربی نیز فرمول مولکولی است. اگر نتیجه یک کسری است، زیرنویس های فرمول تجربی را در مخرج ضرب کنید تا فرمول مولکولی به دست آید.



















