درجه یونش چیست؟ (آموزش کامل معادله ثابت یونش به زبان ساده)
قدرت اسیدی در ترکیبات شیمیایی با استفاده از معیاری به نام ثابت یونش و یا درجه یونش سنجیده می شود. به عبارتی به ثابت تعادل واکنش بین اسید و آب، همان ثابت یونش اسیدی و یا ثابت تفکیک اسید می گویند. وقتی اتم ها و یا مولکول ها با فرایند فیزیکی تبدیل به یون می شوند، فرایند مذکور را یونیزه شدن می گویند.
هر کدام از عناصر جدول تناوبی در ترکیب با عناصر دیگر تولید اسید می کنند. اسیدهای حاصل به یون های تشکیل دهنده خود تفکیک می شوند. برخی از این واکنش ها کامل و برخی دیگر به صورت تعادلی هستند که با توجه به میزان قدرت اسید تعیین می شود. در واقع ثابت یونش به عنوان معیاری است که میزان قدرت اسیدی این ترکیبات را نشان می دهد. درجه یونش و ثابت تعادل اسیدها در این مقاله نشریه جهان شیمی فیزیک بررسی می شود.
ثابت یونش چیست؟
به معیاری که با آن می توان قدرت اسیدها در محلول را با هم مقایسه کرد، ثابت یونش می گویند. ثابت یونش را می توان هم برای اسیدها و هم برای بازها تعریف کرد. این ثابت یونش در اسیدها با Ka و ثابت یونش بازها با Kb نشان داده می شود. ثابت تعادل اسید یا همان ثابت تفکیک اسید به ثابت تعادل واکنش بین اسید و آب گفته می شود. با این کمیت، قدرت نسبی اسید در محلول اندازه گیری می شود. اسیدها با تفکیک شدن در آب، یون های هیدرونیوم و آنیون مزدوج خود را تولید می کند. هر چه میزان تفکیک اسید در آب بیشتر باشد، قدرت اسید بیشتر است.
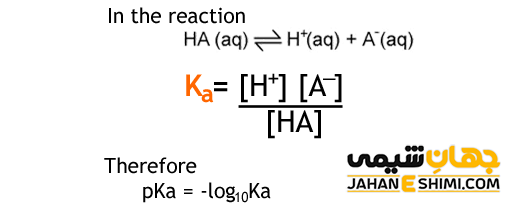
معادله یونش چیست؟
معادله یونش، رابطه ای است که با آن ارتباط بین یون های تولید شده و اسید و یا بازهای تفکیک شده نشان داده می شود. به عنوان مثال در تفکیک یک اسید خواهیم داشت :
HA (aq) + H۲O (l) ↔ H۳O+ (aq) + A– (aq)
حال معادله ثابت یونش برای این اسید از تقسیم حاصل ضرب غلظت های یون های حاصل از تفکیک به غلظت اسید و آب به دست می آید. اما چون غلظت مواد در حالت خالص همیشته ثابت است، در نتیجه غلظت آب برابر با یک بوده و در معادله ثابت تعادل واکنش درج نمی شود. چون اگر در این معادله جای داده شود نیز تاثیری در کل معادله نخواهد داشت. پس معادله ثابت یونش اسید به صورت زیر نوشته می شود.
Ka = [H۳O+] [A–] / [HA]
رابطه بین ثابت یونش و pKa
اسیدها و بازهای حاصل از ترکیب عناصر جدول تناوبی، دارای ثابت یونش Ka هستند که چون عدد بسیار بزرگ و یا کوچکی است، از لگاریتیم منفی این کمیت استفاده می شود. به این معیار جدید تعیین ثابت یونش مواد، pKa برای اسیدها و pKb برای بازها گفته می شود. رابطه بین ثابت یونش با این معیار جدید، رابطه ای ریاضی بوده و به صورت زیرنوشته می شود.
pKa = -log Ka Ka = ۱۰ –pKa
برای بازها :
pKb = -log Kb Kb = ۱۰-pKb
درجه یونش (α)
مواد و مولکول های تشکیل شده از اتصال اتم های جدول تناوبی، به هنگام حل شدن در آب، تولید یون می کنند. مقدار یون های تولید شده از تفکیک مواد مختلف متفاوت است. برای مقایسه بین میزان یونش مواد مختلف از معیاری به نام درجه یونش استفاده می شود. درجه یونش مواد مختلف با (α) نشان داده می شود. مقدار درجه یونش از تقسیم تعداد ذرات یونیده شده بر تعداد ذرات اولیه به دست می آید. اگر بخواهید درصد یونش در مواد را بیان کنیم، درجه یونش را در صد ضرب می کنیم.

با این که در فرمول بیان درجه یونش از ذره استفاده می شود ولی می توان به جای ذره از مول، مولکول و یا غلظت مولار استفاده کرد.
دسته بندی اسیدها با توجه به درجه یونش
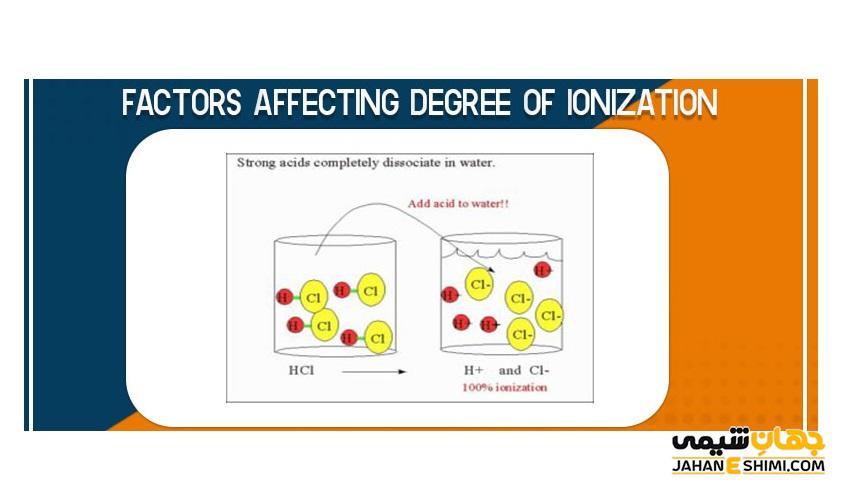
میزان قدرت اسیدها با توجه به میزان یونش و یا تفکیک آن ها هنگام حل شدن در آب تعیین می شود. اسیدهایی که در آب به طور کامل یونیزه شوند، قوی بوده ولی اسیدهایی که تفکیک آن ها به طور جزئی بوده اسدی ضعیف هستند. تفکیک شدن در اسیدهای ضعیف در یک واکنش دو طرفه خواهد بود. در این واکنش، بین یون های حاصل از یونش و مولکول های یونیده شده، تعادل برقرار است.
دامنه تغییرات درجه ی یونش
درجه یونش مواد بین عددهای صفر تا یک متغیر است. وقتی در ترکیباتی مانند اسیدها و بازهای قوی، تفکیک شدن به طور کامل و یک طرفه باشد، درجه یونش برابر یک خواهد بود. به عبارتی در این تفکیک می توان گفت تمام مولکول ها به طور تقریبی تفکیک شده و به یون تبدیل شدند.
اما اسیدها و بازهای ضعیف، چون به طور جزئی تفکیک می شوند، تعداد ذرات کمتری از آن ها یونیده می شود. به طوری که درجه ی یونش آن ها بین صفر تا یک و بیشتر نزدیک به صفر خواهد بود.
اما موادی نیز وجود دارد که تفکیک آن ها با حل شدن در آب برابر صفر خواهد بود. مواد آلی که انحلال مولکولی دارند مانند الکل ها، شکر، گلیسیرین و استون از این نوع مواد هستند.



















