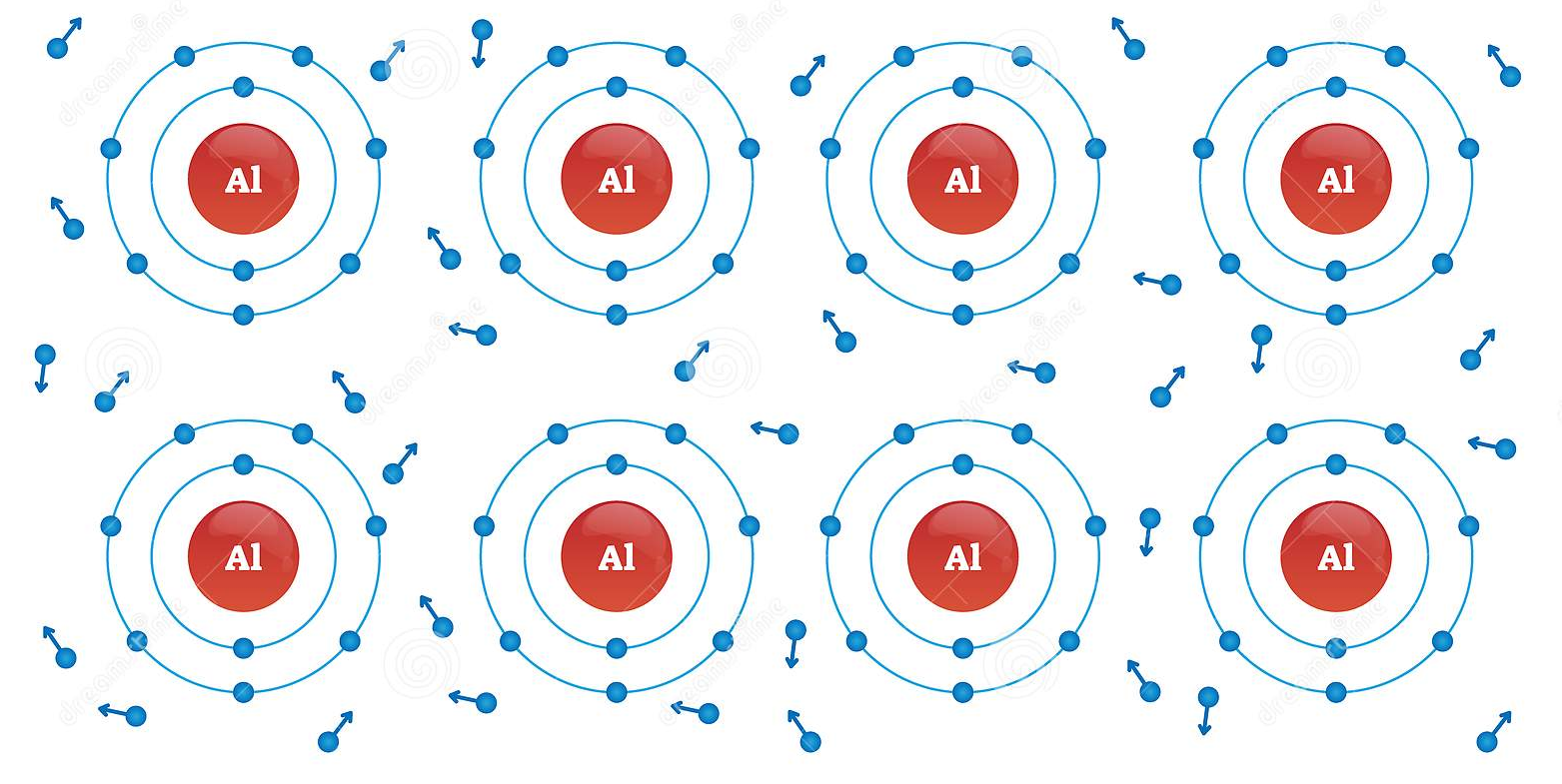
پیوند فلزی (Metallic bond) یک از انواع مختلف پیوند های شیمیایی است که در علم شیمی مطالعه و بررسی میشود. همانطور که از اسم این پیوند مشخص می باشد، پیوندی ویژه میان اتم های فلزات در شبکه بلور است. در واقع این پیوند شامل اشتراک الکترون ها میان شبکه اتم های فلزی است. لازم به ذکر است که تمام ذرات در شبکه بلور فلزی یکسان می باشند و هیچ تفاوتی از نظر الکترون خواهی با هم ندارند .در این مقاله در نشریه جهان شیمی فیزیک، توضیحات بیشتری در رابطه با پیوند فلزی ارائه شده است. لطفا با ما همراه باشید.
فهرست مطالب این مقاله
۱- تعریف پيوند فلزی
۲- تشکیل پيوند فلزی
۳- عوامل موثر بر قدرت پیوند فلزی
۴- شعاع فلزی
۵- توجیه خواص فلزات با پیوند فلزی
۱-۵- رسانایی الکتریکی
۲-۵- رسانایی گرمایی
۳-۵- درخشندگی و جلای فلزات
۴-۵- چکش خواری فلزات
۵-۵- قابلیت انعطاف پذیری و مفتول شدن
۶-۵- پدیده های فوتو الکتریک و ترمو الکتریک
۷-۵- نقطه ذوب و جوش بالا
۶- نمونه هایی از پیوند در فلزات
تعریف پیوند فلزی
همانطور که می دانید، بین اتم های فلز با نا فلز پیوند یونی و بین اتم های نافلزی پیوند کووالانسی تشکیل می شود. اما پیوند های فلزی، سبب اتصال اتم های فلزی به یکدیگر می باشند. این پیوند در واقع نیروی جاذبه ای است که از تاثیر متقابل بین الکترون های لایه ظرفیت (الکترون های آزاد و یا الکترون های غیر مستقر) و هسته اتم ها که بار مثبت دارند به وجود می آید.
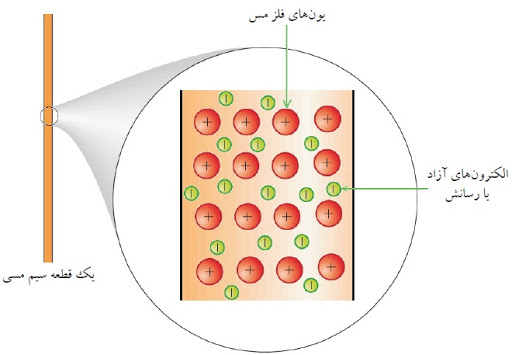
پیوند فلزی علاوه بر فلزات در آلیاژها نیز دیده می شود. در فلزات اتم ها در ساختاری سه بعدی در کنار یکدیگر قرار دارند. الکترون های لایه ظرفیت آزادانه در سراسر این ساختار سه بعدی حرکت می کنند، که به آنها الکترون های رسانش نیز گفته می شود. این الکترون ها وظیفه به هم نگه داشتن لایه مزبور را بر عهده دارند.
تشکیل پیوند فلزی
انرژی یونیزاسیون فلزات نسبت به نا فلزات کمتر می باشد. از طرفی تعداد اوربیتال های خالی اتم فلزات نسبت به تعداد الکترون های لایه ظرفیت آنها کمتر است. زمانیکه اتم های فلزات به منظور تشکیل بلور جامد کنار یکدیگر قرار می گیرند، هر اتم تمام الکترون های لایه ظرفیت خود را به اشتراک می گذارد.
در این حالت، تعدادی از الکترون های لایه ظرفیت اتم فلز، تا حدی از قید جاذبه هسته خود رها می شوند. این الکترون ها دیگر تحت تاثیر جاذبه هسته معینی قرار ندارند و در فضاهای خالی بین اتم های فلز در ساختار بلور قرار می گیرند. الکترون های مذکور دارای آزادی حرکت می باشند و به سرعت بین یون های فلزی حرکت می کنند. در واقع الکترون های آزاد تنها به اتم های مجاور هم تعلق ندارند، بلکه می توان گفت که به تمامی اتم های موجود در شبکه بلور تعلق دارند. به این الکترون ها، ابر الکترونی یا دریای الکترون نیز گفته می شود.
در واقع پیوند فلزی را می توان به این صورت در نظر گرفت که یون های فلزی به طور منظم در دریایی از الکترون قرار گرفته اند. نیروهای جاذبه قدرتمند بین هسته مثبت و الکترون های آزاد، اتم های یک فلز در ساختار بلور را در کنار یکدیگر نگاه داشته است. پیوند فلزی بر خلاف پیوند کووالانسی، پیوندی جهت دار نمی باشد، بنابراین فلزات تمایل زیادی برای تشکیل شبکه های فضایی سه بعدی با متراکم ترین شکل را دارند.
عوامل موثر بر قدرت پیوند فلزی
هر چه تعداد الکترون های آزاد بیشتر باشد، پیوند فلزی قوی تر می باشد. از طرف دیگر، اندازه و بار یون های مثبت در پیوند فلزی نیز در قدرت پیوند تاثیر دارند. هرچه اندازه یون های مثبت در پیوند کوچکتر باشد و بار یون ها نیز بیشتر، پیوند فلزی تشکیل شده قوی تر میگردد. بنابراین برای شکستن پیوند فلزی انرژی زیادی باید صرف شود. در واقع پیوند فلزی از جمله قدرتمندترین پیوند ها محسوب می شود.
فلزات واسطه علاوه بر اوربیتال ۴s، اوربیتال های ۳d را نیز در جریان الکترون های آزاد شرکت می دهند. بنابراین تعداد الکترون های آزاد بیشتر شده و در نتیجه قدرت پیوند فلزی نیز بیشتر خواهد بود.
شعاع فلزی
شعاع فلزی را به صورت نیمی از فاصله تعادلی بین دو هسته در دو اتم مجاور در شبکه بلور فلزها تعریف میکنند. توجه داشته باشید که شعاع فلزی به طبیعت اتم، عدد کوئوردینانسیون و سیستم بلوری فلز بستگی دارد. در واقع اگر فلزی در چند سیستم مختلف متبلور شود، شعاع فلزی آن در سیستم های گوناگون متفاوت خواهد بود. همچنین هرچه عدد کوئوردیناسیون بلور عددی بزرگ تر باشد طول شعاع فلزی آن نیز افزایش می یابد.
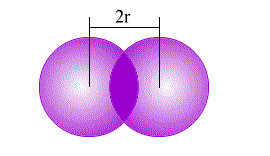
شعاع فلزی در هر دوره از جدول تناوبی همزمان با افزایش بار موثر هسته، کاهش پیدا می کند. از طرفی دیگر در هر گروه با افزایش عدد اتمی از بالا به پایین، شعاع فلزی نیز افزایش می یابد. در فلزات عناصر واسطه، مقدار بار موثر هسته به شدت و بیش از انتظار بالا می رود، بنابراین اندازه شعاع این فلرات به شدت کاهش پیدا می کند.
توجیه خواص فلزات با پیوند فلزی
فلزات خواص متفاوتی از خود نشان می دهند. نیروی جاذبه الکتروستاتیکی بین یون های مثبت فلزی و بار منفی حاصل از توده ابر الکترونی، عامل پیوند بین اتم های فلز محسوب میشود. همانطور که گفته شد، پیوند فلزی دارای جهت خاصی نیست و یون های فلز نیز می توانند در داخل ابر الکترونی در شبکه بلور جابجا شوند. پیوند فلزی بسیاری از خصوصیات فلزات را توضیح می دهد که در ادامه به بررسی این خصوصیات می پردازیم.
رسانایی الکتریکی
بیشتر فلزات رسانای الکتریکی بسیار خوبی می باشند. در واقع جریان الکتریکی نتیجه جابجایی الکترون هاست. همانطور که بیان شد، الکترون های موجود در دریای الکترون آزادانه حرکت می کنند و قادر به جابجایی و حمل بار می باشند. در نتیجه می توان گفت که الکترون ها با حرکت خود، رسانایی ایجاد می نمایند.

رسانایی گرمایی
فلزات گرما را نیز منتقل می کنند. در واقع با افزایش دما بر اثر گرم کردن فلز، جنبش الکترون های آزاد و غیر مستقر افزایش می یابد، و چون این الکترون ها به یکدیگر پیوسته اند، دما به تمام قسمت های فلز منتقل می شود.
درخشندگی و جلای فلزات
فلزات براق اند، بنابراین معمولا جلای فلزی را نشان می دهند. در واقع تابش نور به سطح فلز باعث برانگیخته شدن الکترون های غیر مستقر میشود. بازگشت این الکترون ها از ترازهای بالاتر انرژی به حالت پایه، باعث میشود که امواج نور مرئی از سطح فلز بازتابیده شود.

چکش خواری فلزات
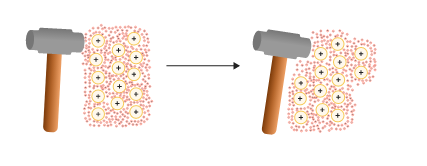
یون های مثبت به وسیله دریای از الکترون احاطه شده اند. این الکترون های آزاد مانند یک ضربه گیر عمل می کنند. زمانیکه ضربه ای به فلز وارد میشود، یون های مثبت فلزی در دریای الکترون منفی جابجا میشوند. به دلیل پیوستگی الکترون های آزاد، ترکیب کلی در ساختار یک فلز تغییر نخواهد کرد. در واقع با تغییر آرایش یون های مثبت فلزی، دریای الکترونی نیز موقعیت خود را تغییر می دهد و جلوی شکستگی فلز را میگیرد.
قابلیت انعطاف پذیری و مفتول شدن
فلزات غالبا انعطاف پذیرند و می توانند به شکل های مفید و مختلف تغییر شکل داده شوند. حتی می توان آنها را به صورت سیم های نازک در آورد. پیوند فلزی بدون جهت می باشد. هنگامی که یک فلز تحت فشار قرار می گیرد، اتم ها ارتباطشان را با یکدیگر تغییر می دهند، یعنی به جای اینکه پیوند بینشان شکسته شود، جهت پیوند تغییر می کند. بنابراین فلزات شکل پذیر بوده و قابلیت مفتول شدن را دارند.

پدیده های فوتو الکتریک و ترمو الکتریک
اگر انرژی که به صورت گرمایی یا تابشی به الکترون های غیر مستقر داده می شود، به حدی باشد که الکترون ها برانگیخته شده و ممکن است از فلز جدا گردند. بنابراین می توان این الکترون های جدا شده را در مدار به جریان الکتریکی تبدیل کرد.

نقطه ذوب و جوش بالا
فلزات به دلیل پیوند فلزی قوی ما بین یون های مثبت و الکترون های غیر مستقر، دارای نقطه ذوب و جوش بالایی می باشند و در حقیقت جامد های محکمی هستند. لازم به ذکر است که پیوند فلزی فقط در زمان جوشیدن فلز شکسته می شود. در واقع این پیوند در زمان ذوب، سست می شود اما شکسته نمی شود.
نمونه هایی از پیوند در فلزات
فلزات مختلف از جمله لیتیم، پتاسیم، طلا، نقره و آهن همگی نمونه هایی از پیوند فلزی می باشند. علاوه بر فلزات، حتی آلیاژهای فلزی نیز نمونه های خوبی از پیوند های فلزی می باشند. مثلا برنج، که آلیاژ مس و روی است،



















