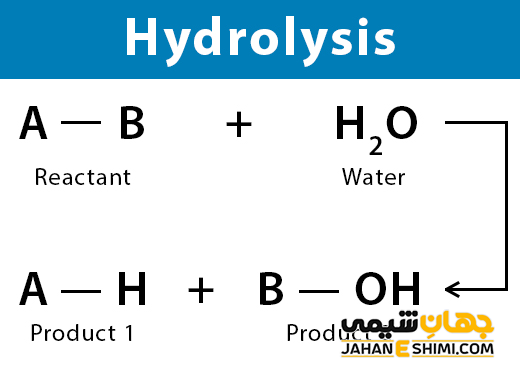
در علم شیمی، آبکافت یا هیدرولیز (Hydrolysis) به واکنشی گفته می شود که در آن، از آب برای شکستن پیوند های شیمیایی یک ماده استفاده می کنند. در طی فرآیند هیدرولیز، یک یا چند مولکول آب، به یون های سازنده خود، یعنی هیدروژن و هیدروکسیل تجزیه می شوند و سپس در واکنش شرکت می کنند. به عبارت دیگر، آبکافت یک واکنش شیمیایی خواهد بود که در آن، ترکیبات شیمیایی در واکنش با آب تجزیه می گردند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی هیدرولیز و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
آبکافت چیست ؟ شیمی یازدهم
کلمه هیدرولیز در واقع از کلمات یونانی هیدرو (Hydro) به معنای آب و لیز (Lysis) به معنای جدا کردن پیوند گرفته شده است. بنابراین همانطور که از نامش مشخص است، آبکافت در حقیقت یک فرآیند تجزیه شیمیایی محسوب می شود. البته توجه داشته باشید که در این واکنش، همزمان با تجزیه آب ممکنست مولکول های دیگری نیز تجزیه شوند. در این صورت، گروه هیدروکسیل به یک قسمت مولکول و گروه هیدروژن به قسمت دیگر مولکول شکسته شده، اضافه می شوند. به بیان دیگر، هیدرولیز از انواع واکنش های شیمیایی می باشد که در طی آن، آب نسبت به ماده دیگر واکنش شیمیایی می دهد، بنابراین باعث تجزیه آن ماده شده و یک یا چند ماده جدید و مستقل از ماده اصلی ایجاد می کند.
این واکنش همچنین سبب یونیزاسیون ماده در محیط آبی می گردد. در واقع ترکیب شدن یک نمک با آب (واکنش نمک با آب و تجزیه آن نمک به وسیله آب و تولید اسید و باز) را هم هیدرولیز می گویند. از طرفی دیگر، واکنش هیدرولیز باعث تجزیه پروتئین ها، پلیمر ها، کربو هیدرات ها، نوکلئو اسید ها و چربی ها نیز می گردد. سرعت این واکنش ها را می توان با استفاده از اسید ها، باز ها و یا آنزیم ها افزایش داد. لازم به ذکر است که عمل هیدرولیز در هنگام هضم غذا در بدن، نیز رخ می دهد. از جمله این موارد می توان به تجزیه ساکروز (قند نیشکر) به گلوکز و فروکتوز اشاره کرد. همچنین تبدیل نشاسته به گلوکز (در حضور یک کاتالیزور مناسب) نیز از نوع این واکنش می باشد.
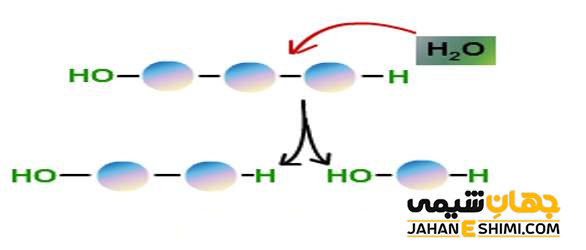
در شیمی آلی، بعضی ترکیبات از متراکم شدن دو ترکیب مختلف و در واقع با از دست دادن یک مولکول آب بوجود آمده اند. از این رو، با انجام فرآیند آبکافت بر روی این ترکیبات، می توان آنها را به ترکیبات سازنده خود تجزیه نمود. به بیان ساده تر می توان گفت که فرآیند آبکافت، معکوس فرآیند آبگیری (تغلیظ یا چگالش) می باشد. این فرآیند اغلب یک فرآیند برگشت پذیر است. بنابراین همان ترکیب اولیه را معمولا می توان با آب گیری از ترکیب هیدرولیز شده، بدست آورد. البته توجه داشته باشید که فرآیند آبکافت، تحت شرایط خاصی ممکنست برگشت ناپذیر باشد. به عنوان مثال، اگر فرآیند آبکافت بر روی نمک خوراکی انجام شود، بد از گذشت مدت زمانی، بوی کلر از ظرف به مشام می رسد، بنابراین موادی که در این حالت تجزیه شده اند دیگر قابل بازیابی نیستند.
چگونگی فرآیند هیدرولیز
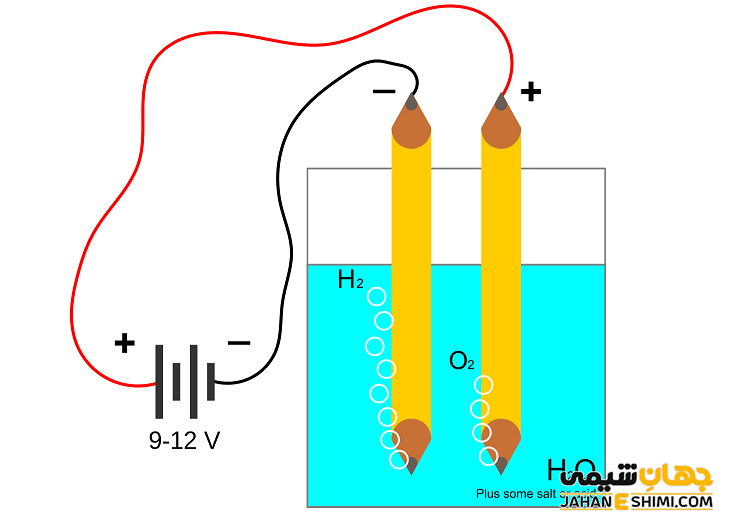
در فرآیند هیدرولیز، جریان برق و قطب های آن جهت تجزیه ماده محلول در آب مورد استفاده قرار می گیرد. از آنجاییکه آب یک ترکیب یونی و دارای بار الکتریکی می باشد، پس ترکیبی که می خواهد در آن حل شود نیز بایستی یونی انتخاب شود. در این صورت و با اتصال جریان الکتریسیته، ملکول های دارای بار مثبت نمونه حل شونده، به سمت قطب منفی حرکت می کنند، از قطب منفی الکترون گرفته و به شکل خنثی بر می گردند. این عمل باعث تجزیه نمونه مورد نظر محلول در آب می شود.
به بیان دیگر، زمانیکه یک نمک وارد آب شود، یونیزه خواهد شد. زیرا آب، خودش نیز کمی به صورت یونیزه می باشد. در این صورت یون های مثبت فلزی نمک مورد نظر با یون های آب به شکل باز در می آیند، در حالیکه یون های منفی آن نمک، با یون های آب اسید تولید می کنند. به همین دلیل به این فرآیند آب، آبکافت می گویند. توجه داشته باشید که هیدرولیز همچنین سبب کاهش طول زنجیر و در واقع کاهش اندازه مولکول ها می شود. این عمل خود باعث می شود که قابلیت انحلال پذیری نمونه مورد بررسی زیاد شود.
انواع هیدرولیز
هیدرولیز نمک
همان طور که می دانید، نمک ها بر اثر واکنش میان اسید و باز بوجود می آیند. به عبارت دیگر، نمک محصول واکنش خنثی شدن یک اسید به وسیله یک باز می باشد. به نمکی که محلولش در آب از لحاظ اسیدی و بازی خنثی باشد، نمک خنثی می گویند. بدین صورت نمکی که از واکنش اسید قوی با باز قوی تشکیل شده باشد و بر اثر هیدرولیز در آب بتواند همان اسید و باز قوی را (با ظرفیت برابر) تولید کند، پس محلولش در آب نیز خنثی خواهد بود. اما توجه داشته باشید که نمک حاصل از واکنش خنثی شدن، همیشه خنثی نخواهد بود.
کاتیون مربوط به باز های قوی (یعنی کاتیون های فلزات گروه ۱ و ۲ جدول تناوبی به استثنای +Be۲ و +Mg۲ هیدرولیز نمی شوند. زیرا این کاتیون ها تمایلی جهت جذب یون –OH(aq) ندارند. در حالیکه، کاتیون های مربوط به باز های ضعیف تمایل به جذب یون –OH(aq) دارند، پس آبکافت می شوند. حال هر چه باز مورد نظر ضعیف تر باشد، شدت هیدرولیز کاتیون نیز بیشتر خواهد بود. از طرفی، هر چه هیدرولیز کاتیون شدیدتر باشد، در نتیجه PH محلول کمتر خواهد بود و محیط اسیدی تر می شود.
به طور مشابه، آنیون مربوط به اسید های قوی (مانند –CLO۳–، HSO۴–، CL–، Br–، I–، CLO۴ و –NO۳) هیدرولیز نمی شوند. زیرا این آنیون ها تمایلی جهت جذب یون +H(aq) ندارند. در حالیکه، آنیون های مربوط به اسید های ضعیف تمایل به جذب یون هیدروژن دارند، پس آبکافت می شوند. حال هر چه اسید مورد نظر ضعیف تر باشد، شدت هیدرولیز آنیون نیز بیشتر خواهد بود. از طرفی، هر چه آبکافت آنیون شدید تر باشد، در نتیجه PH محلول بیشتر خواهد بود و محیط قلیایی تر می شود.
توجه داشته باشید که اگر بار منفی آنیون یک اسید نسبت به آنیون دیگر همان اسید، بیش تر باشد، در نتیجه بهتر آبکافت خواهد شد. به عنوان مثال، شدت آبکافت آنیون های فسفات به شکل –H۲PO۴– < HPO۴۲- < PO۴۳ است. در ادامه مقاله به بررسی انحلال انواع نمک ها (نمک اسیدی، نمک بازی و یا نمک خنثی) در آب می پردازیم.

نمک اسیدی
(نمک اسید قوی و باز ضعیف مانند ترکیب NH۴NO۳). نمکی اسیدی به نمکی گفته می شود که از ترکیب یک اسید قوی (مثلا اسید نیتریک) با یک باز ضعیف (مثلا هیدروکسید آمونیوم) بوجود آمده باشد. در اثر حل شدن این نمک در آب، یون های +NH۴ (aq) و NO۳– (aq) آزاد می شوند. همانطور که مشخص است آمونیوم، کاتیون یک باز ضعیف و آنیون نیترات، آنیون یک اسید قوی می باشند. از آنجاییکه آنیون، مربوط به یک اسید قوی است، بنابراین هیدرولیز نمی شود. در نتیجه تنها کاتیون آمونیوم آبکافت می گردد. این کاتیون، یون های هیدروکسید را از محلول جذب نموده و به صورت یک باز ضعیف در می آید. در نهایت PH محلول را پایین آورده و محیط را اسیدی می کند. بنابراین این گونه نمک ها را، نمک اسیدی می نامند.
نمک بازی
(نمک باز قوی و اسید ضعیف مانند ترکیب KF). نمکی بازی به نمکی گفته می شود که از ترکیب یک اسید ضعیف (مثلا اسید فلوئوریدریک) با یک باز قوی (مثلا هیدروکسید پتاسیم) بوجود آمده باشد. در اثر حل شدن این نمک در آب، یون های +K (aq) و F– (aq) آزاد می شوند. همانطور که مشخص است پتاسیم، کاتیون یک باز قوی و آنیون فلور، آنیون یک اسید ضعیف می باشند. از آنجاییکه کاتیون، مربوط به یک باز قوی است، بنابراین هیدرولیز نمی شود. در نتیجه تنها آنیون فلور آبکافت می گردد. این آنیون، یون های هیدروژن را از محلول جذب نموده و به صورت یک اسید ضعیف در می آید. در نهایت PH محلول را بالا آورده و محیط را بازی می کند. بنابراین این گونه نمک ها را، نمک بازی می نامند.
نمک اسید ضعیف و باز ضعیف
(نمک اسید ضعیف و باز ضعیف مانند ترکیب CH۳COONH۴). این نمک از ترکیب یک اسید ضعیف (مثلا اسید استیک) با یک باز ضعیف (مثلا هیدروکسید آمونیوم) بوجود آمده است. در اثر حل شدن این نمک در آب، یون های +NH۴ (aq) و CH۳COO– (aq) آزاد می شوند. همانطور که مشخص است آمونیوم، کاتیون یک باز ضعیف و آنیون استات نیز آنیون یک اسید ضعیف می باشند. بنابراین هر دو یون هیدرولیز می شوند. توجه داشته باشید که PH محلول، بستگی به ثابت تفکیک اسید و باز دارد. در مثال ذکر شده، محلول خنثی می باشد، زیرا محصولات ظرفیت ها و ثابت تفکیک یونی یکسانی دارند.
نمک خنثی
(نمک باز قوی و اسید قوی مانند ترکیب NaCL). نمکی خنثی به نمکی گفته می شود که از ترکیب یک اسید قوی (مثلا اسید کلریدریک) با یک باز قوی (مثلا هیدروکسید سدیم) بوجود آمده باشد. در اثر حل شدن این نمک در آب، یون های +Na (aq) و CL– (aq) آزاد می شوند. همانطور که مشخص است سدیم، کاتیون یک باز قوی و آنیون کلر نیز آنیون یک اسید قوی می باشند. بنابراین هیچ یک از دو یون هیدرولیز نمی شوند. در نتیجه تغییری در PH محلول صورت نمی گیرد (PH = 7)، بنابراین این نمک خنثی خواهد بود.
هیدرولیز آمینو اسید ها
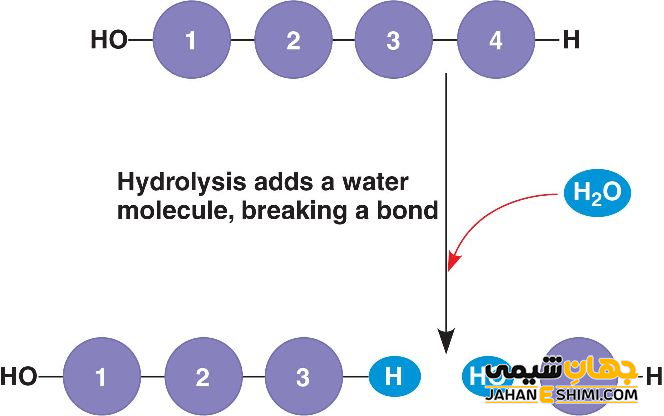
آمینو اسید ها ترکیبات دو گانه ای از گروه های کاربردی آمین و اسید کربوکسیلیک می باشند. در طی فرآیند آبکافت، بخشی از این ترکیبات که شامل قسمت اسید کربوکسیل است، یون هیدروکسیل آب را جذب می کند، در حالیکه بخش آمین مولکول پروتون را جذب می نماید
هیدرولیز آمید ها
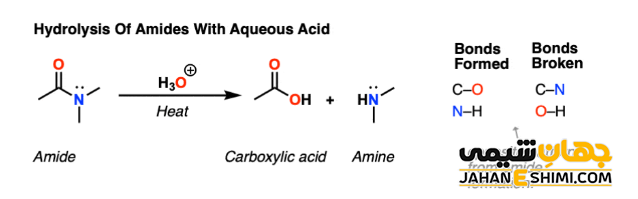
در فرآیند آبکافت یک آمید که به گروه کربوکسیلیک اسید متصل شده است، طی واکنش با آب، پروتون به وسیله مولکول های آمونیاک جذب می شود، در حالیکه گروه هیدروکسیل به وسیله بخش کربوکسیلیک اسید جذب می گردد.
هیدرولیز استر ها
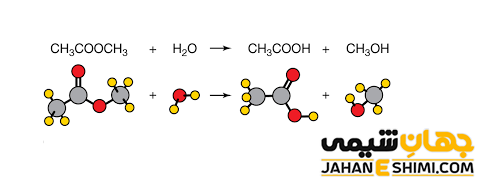
همانطور که می دانید یک استر از ترکیب الکل و اسید کربوکسیلیک ایجاد شده است. در طی فرآیند آبکافت، استر در حضور آب و اسید قوی حرارت داده می شود. در اینجا با شکستن مولکول استر، دو محصول خواهید داشت؛ یک محصول دارای گروه هیدروکسید و محصول دیگر دارای گروه عاملی اسید کربوکسیلیک خواهد بود. در واقع، بخشی از مولکول اولیه که در ابتدا نیز به شکل کربوکسیلات بوده است، هیدروژن آب را دریافت می کند و اسید کربوکسیلیک مربوطه تشکیل می شود. اما بخش دوم مولکول مادر که دارای گروه آلکیل بوده است، گروه هیدروکسیل مولکول آب را جذب نموده و به الکل تبدیل می شود.
لازم به ذکر است که هیدرولیز استر در محیط اسیدی یا بازی می تواند انجام شود. توجه داشته باشید که هیدرولیز با کاتالیست اسیدی واکنشی برگشت پذیر است، در حالیکه هیدرولیز از طریق کاتالیست بازی برگشت ناپذیر خواهد بود. زیرا واکنش در محیط بازی و در مرحله آخر به سمت کامل شدن پیش می رود، پس اسید کربوکسیلیک در نهایت به یون کربوکسیلات تبدیل می گردد.
هیدرولیز پلی ساکاریدها
پلی ساکارید از واحد های مونو ساکارید که به وسیله پیوند های گولیکوزیدی به یکدیگر متصل شده اند، تشکیل شده است. با فرآیند هیدرولیز می توان این پیوند های گولیکوزیدی را شکست، آنها را به مونوساکارید های سازنده تبدیل نمود. به عنوان نمونه، هیدرولیز ساکاروز برای تهیه گلوکز و فروکتوز.
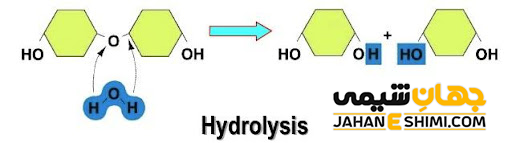
کاربرد های آبکافت
در شیمی آلی، هیدرولیز کاربرد های بسیار زیادی دارد و معمولا به عنوان فرآیند معکوس عمل چگالش بکار می رود. اما در علم بیوشیمی، هیدرولیز در حقیقت فرآیند مقابل دهیدراته شدن یا آب گیری می باشد که طی آن، مولکول آب به فرآیند اضافه می گردد. توجه داشته باشید که هیدرولیز در علم الکتروشیمی نیز کاربرد دارد. در واقع با کمک اختلاف پتانسیل در محلول، مولکول آب به اجزای سازنده خود، یعنی اکسیژن و هیدروژن تجزیه می شود. در شیمی پلیمر، هیدرولیز در واکنش هایی با دمای بالا اتقاق می افتد و باعث تغییر ساختار پلیمر و در نتیجه از بین رفتن خواص آن پلیمر می شود.
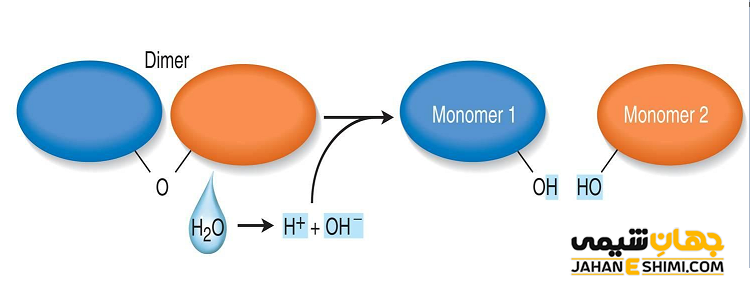
هیدرولیز به چه معناست
هیدرولیز یک واکنش شیمیایی است که در آن یک ترکیب با آب واکنش می دهد که در نهایت منجر به شکستن پیوندهای درون آن ترکیب می شود. این واکنش دو یا چند ترکیب را ایجاد می کند که یون های ساده هستند. در هیدرولیز، آب به یون های هیدروژن (H+) و یون های هیدروکسید (OH-) تقسیم می شود که سپس در شکستن پیوندهای درون خود ترکیب شرکت می کنند.
هیدرولیز یک فرآیند شیمیایی است که در آن یک ترکیب شیمیایی با مولکولهای آب برهمکنش میکند که باعث شکافتن پیوندهای بین اتمهای درون مولکول و تشکیل پیوند جدید میشود. این واکنش تا حدی بر بریدگی یک مولکول در حین افزودن یک مولکول آب تأثیر می گذارد. مکانیسم این فرآیند به شرح زیر است:
حمله هسته دوست: مولکول آب به عنوان یک هسته دوست، با کربنی که در مرکز الکتروفیل ترکیب هدف قرار دارد، پیوند ایجاد می کند.
شکاف پیوند: اتم تحت حمله هماهنگی و اتم مجاور پیوندی مشترک دارند که برای اولی مضر است.
یونیزاسیون: بنابراین قطعات اولیه ایجاد شده میتوانند به یون تبدیل شوند یا پروتونها را اهدا کنند/از خود خارج کنند تا گونههای جدیدی را تشکیل دهند که با تشکیل واسطه واکنش پایدارتر خواهند بود.
تشکیل محصولات: هنگامی که یک حمله الکتروفیل وجود دارد، پیوندها شکسته می شوند، بنابراین ترکیبات جدیدی توسط یک قسمت که گروه هیدروکسیل (-OH) و قسمت دیگر یون هیدروژن (H+) را نشان می دهد، ایجاد می شود.
اساساً، واکنش های هیدرولیز، واکنش بین مولکول های آب برای تبدیل ترکیبات شیمیایی پیچیده به محصولات ساده تر از طریق تجزیه مولکول ها است. هیدرولیز شامل مفهوم درجه هیدرولیز (α) است که مقدار ترکیبی را که به صورت هیدرولیتیک تجزیه می شود، تعریف می کند. این کارایی واکنش هیدرولیز را نشان می دهد و نتیجه معمولاً به طور مستقیم با کسر / درصد هیدرولیز متناسب است.