در علم شیمی، استر (Ester) به ترکیبات آلی اکسیژن داری گفته می شود که گروه عاملی استری -COO- دارند. در واقع استر ها، اسید های کربوکسیلیکی محسوب می شوند که در آنها، هیدروژن گروه کربوکسیل (COOH) با یک گروه آلکیلی یا آریلی (آروماتیک) جایگزین شده است. یک استر را میتوان با فرمول R۱COOR۲ بیان کرد. به بیان ساده تر، استرها مشتقی از اسید های کربوکسیلیک هستند. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی استر و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
استر چیست شیمی یازدهم
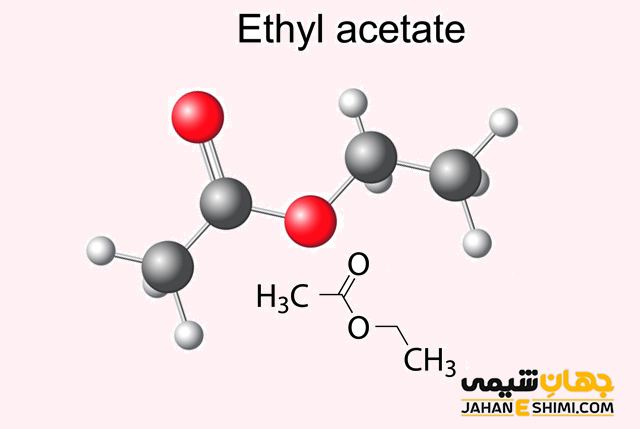
اصطلاح استر برای اولین بار در سال ۱۸۴۸ میلادی، توسط شیمیدان آلمانی یعنی لئوپولد گملین (Leopold Gmelin) ابداع شد. احتمالا این کلمه از واژه آلمانی (Essigäther) به معنی اتیل استات یا اتیل اتانوات (C۴H۸O۲) گرفته شده است.
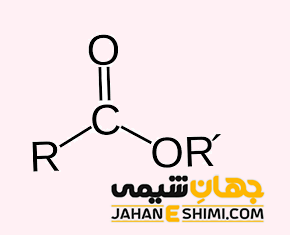
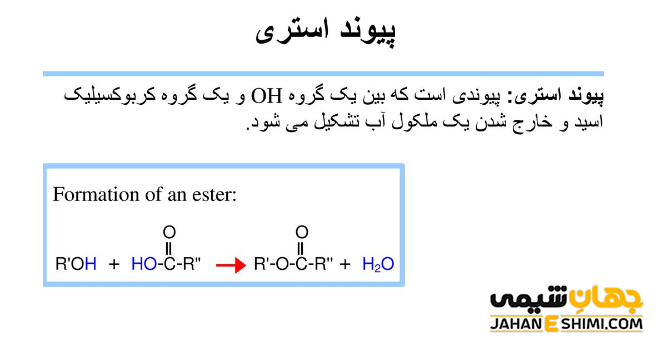
استر ها از الکل ها و اسید های کربوکسیلیک بدست می آیند. در واقع با ترکیب این دو ماده و حذف یک مولکول آب، یک مولکول استر تشکیل می شود. همانطور که بیان شد، اگر در گروه عاملی کربوکسیل، به جای اتم هیدروژن اسیدی، یک گروه هیدروکربنی قرار بگیرد، استر بدست خواهد آمد. بنابراین می توان گفت که استر ها شبیه کربوکسیلیک اسید ها می باشند. فرمول عمومی هر دوی آنها به شرط تک عاملی بودن، به شکل CnH۲nO۲ است. تفاوت اصلی میان آنها در ساختار شیمیایی است. جالب است بدانید که کربوسیلیک اسید ها و استر های هم کربن با یکدیگر ایزومر هستند.
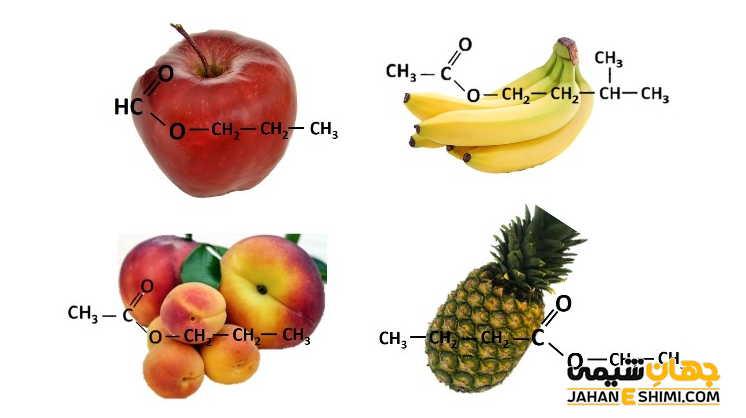
استرها در زیست شناسی بسیار مهم می باشند، زیرا یکی از کلاس های اصلی لیپیدها محسوب می شوند. علاوه بر آن، بخش عمده ای از چربی های حیوانی (Fats) و روغن های گیاهی (Oils) را نیز تشکیل می دهند. لازم به ذکر است که تفاوت بین روغن و چربی، در حقیقت نقطه ذوب استرها است. اگر نقطه ذوب ترکیب مورد نظر، کمتر از دمای اتاق باشد، استر به حالت مایع و به عنوان روغن (روغن نباتی) محسوب می شود. در حالیکه، اگر استر در دمای اتاق جامد باشد (نقطه ذوب، بالاتر از دمای اتاق)، به عنوان یک چربی (مثلا کره یا گوشت خوک) در نظر گرفته می شود. این ترکیبات به طور طبیعی در میوه هایی مانند موز (پنتیل اتانوات)، سیب (متیل بوتانوات)، انگور (اتیل هپتانوات)، آناناس (اتیل بوتانوات) و غیره وجود دارند.
خواص فیزیکی و شیمیایی استر ها
بسته به طول زنجیره های متفاوت استر ها، این دسته از ترکیبات آلی، خصوصیات فیزیکی و شیمیایی مختلفی را نشان می دهند. همانطور که در شکل زیر مشاهده می کنید، مولکول های استر به دلیل داشتن گروه کربونیل، دارای ساختار مثلثی با زاویه های پیوندی ۱۲۰ درجه میان پیوند های C–C–C و C–C–O هستند. استر ها ترکیباتی قطبی محسوب می شوند. قطبیت آنها از اتر ها بیشتر است، اما نسبت به الکل ها کمتر می باشد.
این ترکیبات از طریق گروه کربونیل می توانند با سایر مولکول ها پیوند هیدروژنی بدهند. لازم به ذکر است که آنها نیز همانند اتر ها یا آلدئید ها و کتون ها، تنها می توانند به عنوان گیرنده های هیدروژن باند و نه اهدا کنندگان هیدروژن باند، جهت تشکیل پیوند های هیدروژنی وارد عمل شوند. بنابراین مولکول های استر قابلیت تشکیل پیوند هیدروژنی با یکدیگر را ندارند. نقطه جوش آنها نیز بسیار نزدیک به نقطه جوش ترکیباتی همچون آلدئید ها و کتون ها با همان تعداد اتم کربن است.
همان طور که گفته شد، مولکول های استر می توانند با مولکول های آب، پیوند هیدروژنی تشکیل دهند. بنابراین استر های سبک در آب انحلال پذیر هستند. اما با افزایش تعداد کربن های آنها، از حلالیت در آب به تدریج کاسته می شود. هیدروژن های آلفای این ترکیبات (هیدروژن های متصل به گروه کربونیل)، تا حدودی اسیدی هستند. دقت داشته باشید که استرها تنها زمانیکه در حضور باز های بسیار قوی قرار می گیرند، خاصیت اسیدی از خود نشان می دهند. بسیاری از استر ها بویی شبیه میوه ها و همچنین عطر گل ها را دارند.
ایزمری ساختاری
با توجه به فرمول استرها (′RCOOR)، با تغییر اندازه و یا شکل گروه های هیدروکربنی R و ′R، ایزومر های ساختاری در استرها بدست می آیند. لازم به ذکر است که در این دسته از ترکیبات، گروه R می تواند اتم هیدروژن باشد، در حالیکه گروه کربنی ′R نمی تواند هیدروژن باشد. به بیان دیگر، در این ترکیبات اکسیژن دار، R بخش هیدروکربنی الکل است، در حالیکه ′R اسید کربوکسیلیک می باشد. به عنوان مثال، در شکل زیر، ایزومر های ساختاری برای ترکیبی با فرمول مولکولی C۴H۸O۲ آورده شده است.
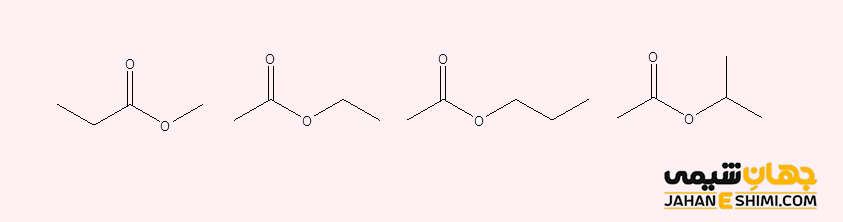
نامگذاری استرها
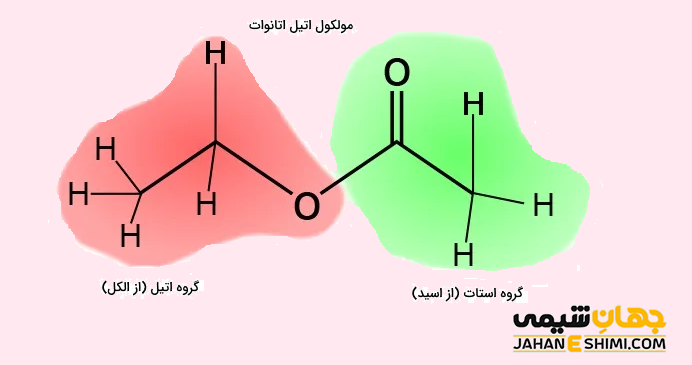
در نامگذاری آیوپاک، این دسته از ترکیبات به شکل آلکیل آلکانوات نامگذاری می شوند. در این روش، ′R به گروه آلکیل و RCOO به گروه آلکانوات مربوط می شود. به بیان ساده تر، برای نامگذاری آنها، در ابتدا گروه متصل به اکسیژن (گروه آلکیل) آورده می شود. در ادامه، نام زنجیر اصلی که شامل گروه کربوکسیلات است (بر وزن آلکانوات ) را می نویسند. به عنوان نمونه به نامگذاری استر های متیل متانوات یا متیل فرمات (HCOOCH۳)، اتیل اتانوات یا اتیل استات (CH۳COOCH۲CH۳)، متیل اتانوات (CH۳COOCH۳)، اتیل متانوات (HCOOCH۲CH۳) و اتیل پروپانوات (CH۳CH۲COOCH۲CH۳) توجه کنید. لازم به ذکر است که تانوات و متانوات دو ترکیب از بنیان های آلکانوات محسوب می شوند. بنابراین علاوه بر نام آیوپاک خود به ترتیب با نام های استات و فرمات نیز شناخته می شوند.
سنتز استر
اولین و قدیمی ترین روش سنتز استر ها، واکنش تعادلی استری شدن (Esterification) است. در این واکنش، اسید آلی (اسید کربوکسیلیک) با الکل در حضور اسید معدنی (بیشتر اسید سولفوریک) واکنش داده و در طی آن، یک استر و آب تولید می شود. لازم به ذکر است که خیلی از استر ها را می توان به طور مستقیم با این روش سنتز کرد. واکنش کلی به استریفیکاسیون فیشر (Fischer esterification or Fischer–Speier esterification) معروف است. در این واکنش در حقیقت یون های هیدروکسیل از اسید و هیدروژن از الکل جدا شده و آب تولید می شود. این واکنش در حضور کاتالیزور مناسبی مثل H۲SO۴ انجام می شود.
RCO۲H + R′OH ⇌ RCO۲R′ + H۲O
همانطور که بیان شد، واکنش استری شدن یک واکنش تعادلی است. بنابراین می تواند در جهت برگشت نیز انجام شود. در این حالت، مولکول آب با استر واکنش داده و در نتیجه اسید کربوکسیلیک و الکل اولیه را تولید می کند. به عکس واکنش استری شدن، واکنش آبکافت یا هیدرولیز گفته می شود. برای پیشرفت واکنش در جهت رفت و تولید استر، از اصل لوشاتلیه بهره می برند. به عنوان نمونه، الکل با مقادیر بسیار زیاد به عنوان حلال استفاده می شود. عوامل دهیدراته کننده در واکنش بکار می رود. مثلا اسید سولفوریک علاوه بر اینکه کاتالیزور واکنش است، آب تولیدی را نیز می تواند از واکنش جدا کند. یا حتی می توان از ابزار های فیزیکی مثل تقطیر، آب را جدا کرد.
سایر روش های تولید
برای تهیه و سنتز استرها چندین روش مختلف دیگر نیز وجود دارد. در ادامه مقاله، این روش ها را نیز بررسی می کنیم.
۱- واکنش الکلیز (Alcoholysis) میان آسیل کلرید ها و انیدرید اسید ها؛ الکل ها در واکنش با اسید انیدرید ها و آسیل کلرید ها بر طبق واکنش های زیر استر تولید می کنند.
RCOCl + R′OH → RCO۲R′ + HCl
(RCO)۲O + R′OH → RCO۲R′ + RCO۲H
۲- واکنش کربونیل دار کردن (Carbonylation)؛ آلکن ها در حضور کاتالیزور های کربونیل فلزی، تحت واکنش هیدرواستریفیکاسیون قرار می گیرند. استر های بدست آمده به کمک این روش، به منظور تولید تجاری اسید پروپیونیک و اسید فرمیک کاربرد دارند.
C۲H۴ + ROH + CO → C۲H۵CO۲R
۳- استریفیکاسیون کربوکسیلیک اسید ها با اپوکسید ها؛ اسید های کربوکسیلیک با استفاده از اپوکسید ها، استری می شوند و در نتیجه β- هیدروکسی استر ها را می دهند. این واکنش در تولید رزین وینیل استر مورد استفاده قرار می گیرد.
RCO۲H + RCHCH۲O → RCO۲CH۲CH(OH)R
۴- واکنش ترانس استری شدن (Transesterification)؛ استر ها در محیط های اسیدی یا بازی با الکل ها واکنش داده و می توانند به استر دیگری تبدیل شوند.
RCO۲R′ + CH۳OH → RCO۲CH۳ + R′OH
۵- اضافه کردن اسید های کربوسیلیک به آلکن ها و آلکین ها؛ واکنش این روش به صورت زیر است. همانطور که مشاهده می کنید مولکول های اتیلن، اسید استیک و اکسیژن در حضور کاتالیزور (با پایه پالادیوم)، با همدیگر واکنش داده و تولید وینیل استات (Vinyl Acetate) تولید می شود.
C۲H۴ + CH۳CO۲H + ۱⁄۲ O۲ → C۲H۳O۲CCH۳ + H۲O
واکنش های استر ها
این دسته از ترکیبات در بسیاری از واکنش های آلی شرکت می کنند. گروه کربونیل در آنها، یک گروه الکترون دوست ضعیف محسوب می شود. اما در عین حال، مهمترین مرکز واکنش آنهاست. در واقع به دلیل وجود پیوند دوگانه کربن- اکسیژن و همچنین با توجه به قطبی بودن این پیوند، گروه های هسته دوست (مانند آمین ها، هیدرید ها، آلکوکسید ها و یا ترکیبات اورگانو لیتیومی) می توانند به گروه عاملی کربونیل حمله کنند. علاوه بر آن، پیوند های کووالانسی کربن- هیدروژن در همسایگی گروه عاملی کربونیل، خاصیت اسیدی ضعیفی دارند. در نتیجه در هنگام واکنش با باز های قوی، می توانند پروتون از دست دهند. جالب است بدانید که واکنش ذکر شده می توان باعث بروز واکنش های تراکمی شود.

هیدرولیز و صابون سازی
همانطور که بیان شد، واکنش استری شدن یک واکنش برگشت پذیر می باشد. در واقع استر ها به کمک اسید و باز در واکنش های آبکافت شرکت می کنند. منظور از آبکافت یا هیدرولیز در ترکیبات آلی، واکنش یک ماده شیمیایی با آب یا قسمتی از آب (–OH یا +H۳O) است، که در طی آن، اسید یا باز اولیه بدست می آید. این واکنش ها در محیط اسیدی، به عنوان واکنش برگشتی استریفیکاسیون فیشر خواهند بود. در حالیکه، در محیط بازی، عامل هیدروکسید به عنوان هسته دوست عمل نموده و باعث می شود که گروه آلکوکسی خارج شوند. به این واکنش، واکنش صابونی شدن گفته می شود و در حقیقت فرآیند اصلی در صابون سازی می باشد. لازم به ذکر است که آبکافت استر در مجاورت اسید های معدنی، باعث تشکیل اسید و الکل مربوطه می گردد.
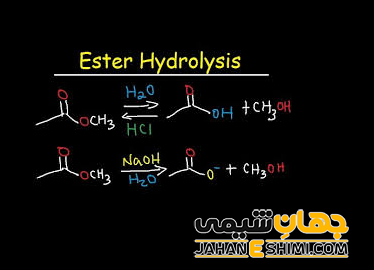
توجه داشته باشید که از واکنش استرها با باز های قوی همچون هیدروکسید سدیم (NaOH) و هیدروکسید پتاسیم (KOH)، نمک اسید کربوکسیلیک و الکل تشکیل می شود. جالب است بدانید که این واکنش، یک واکنش کامل و برگشت ناپذیر می باشد که به آن هیدرولیز استر در محیط قلیایی می گویند. حالت ویژه و خاصی از واکنش استرها با باز های قوی، واکنش سه مول تری گلیسیرید با سه مول KOH است. در این صورت، سه مول صابون و یک مول گلیسیرین حاصل می شود که به آن واکنش صابونی شدن می گویند. به عبارت دیگر می توان گفت که واکنش صابونی شدن در واقع همان هیدرولیز تری گلیسیرید در محیط قلیایی است.
احیای استر ها
استر ها در مقایسه با کتون ها و آلدئید ها، نسبتا در برابر کاهش مقاوم هستند. یک کاتالیزور معمولی برای این واکنش کرومیت مس (Cu۲Cr۲O۵) است. در نهایت استر های اسید های چرب با فرآیند احیا و هیدروژنه شدن به الکل های چرب تبدیل می شوند.
تراکم کلایزن
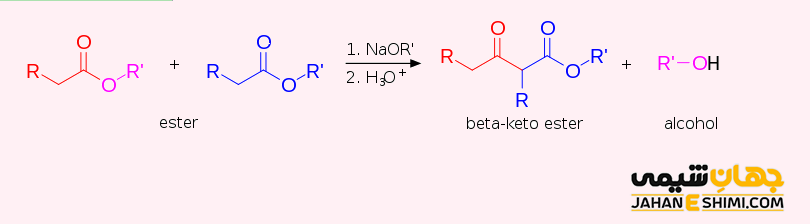
تراکم کلایزن (Claisen condensation) یک نوع واکنش تراکمی است که در طی آن، یک استر می تواند با یک استر دیگر و یا حتی با یک ترکیب کربونیل دار واکنش دهد. محصول این واکنش، یک بتا- کتو استر یا یک بتا- دی کتون خواهد باید. توجه داشته باشید که این واکنش حتما باید در محیط بازی انجام شود. این تراکم، اولین بار در سال ۱۸۸۷ میلادی توسط یک شیمیدان آلمانی یعنی رینر لودویگ کلایزن (Rainer Ludwig Claisen) کشف شده است.
تراکم دیکمان
تراکم دیکمان (Dieckmann condensation) یک نوع واکنش تراکمی درون مولکولی است که مختص دی استرها است. محصول این واکنش، یک بتا- کتواستر خواهد باید. توجه داشته باشید که این واکنش حتما باید در محیط بازی انجام شود. تراکم دیکمان، به افتخار شیمیدان آلمانی یعنی والتر دیکمان (Walter Dieckmann) نامیده شده است.
کاربرد های استر
استر ها ترکیبات بسیار ارزشمندی می باشند که در صنعت به عنوان حلال، ماده اولیه پلیمرها و همچنین مواد دارویی کاربرد دارند. این ترکیبات، حلال هایی قوی محسوب می شوند که در فرآیند تهیه پلاستیک ها، مواد براق کننده، رزین ها و نوع خاصی از پلیمرها مثل نیترو سلولز مورد استفاده قرار می گیرند. همچنین پلی استرها اغلب در مواد پلاستیکی کاربرد دارند. نیترات های آن همچون نیتروگلیسیرین، خاصیتی انفجاری نشان می دهند. به علاوه، فسفو استرها نیز ساختار اصلی DNA را تشکیل داده اند. گلیسیریدها، که در حقیقت استر اسیدهای چرب گلیسرول می باشند، نقش مهمی در بیولوژی دارند.
این ترکیبات طعم و بوی خوش، شیرین و مطبوعی دارند، بنابراین در شیرینی ها، بستنی ها، مواد آرایشی، صابون ها، شامپو ها و سایر محصولات تجاری بکار می روند. به عنوان مثال، یکی از این ترکیبات، متیل سالیسیلات است که به عنوان طعم دهنده مواد غذایی و همچنین دارویی کاربرد دارد. در عطر ها، اغلب از استر با جرم مولکولی کم بهره می برند. البته توجه داشته باشید که استرها ممکن است در عرق بدن به آرامی هیدرولیز شوند. در این صورت، اسید کربوکسیلیک حاصل از فرآیند آبکافت، می تواند بوی نامطبوعی داشته باشد. از استرهای زنجیره ای بسیار بلند در ساخت شمع استفاده می کنند.
علاوه بر موارد گفته شده، این ترکیبات می توانند اثر دارویی مثبت نشان دهند. از این جهت، صنعت داروسازی به دنبال سنتز استرهای مشتق از اسید های موجود در بدن است. آسپرین و ویتامین C (آسکوربیک اسید) از ساده ترین نمونه های این استرها می باشند.



















