در شیمی آلی، واکنش جانشینی (Substitution reactionn) به واکنش شیمیایی گفته می شود که در آن، یک گروه عاملی از یک ترکیب می تواند با گروه عاملی دیگری از ترکیب دوم جابجا شود. این واکنش همچنین با نام های واکنش جانشینی منفرد (single substitution reaction) یا واکنش جابجایی منفرد (single displacement reaction) نیز شناخته می شود. البته دقت داشته باشید که واکنش های جانشینی دوگانه نیز نوع خاصی از واکنش های جانشینی محسوب می شوند. لازم به ذکر است که بسته به نوع واکنش دهند ها (ریجنت)، واکنش جانشینی اغلب به دو نوع هسته دوستی و الکترون دوستی تقسیم می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی واکنش جانشینی و انواع مختلف آن پرداخته می شود. لطفا با ما همراه باشید.
انواع واکنش جانشینی
واکنش های جابهجایی در شیمی آلی از اهمیت بسیار بالایی برخوردار هستند. واکنش های جانشینی بسته به نوع حد واسط های فعال در واکنش که می توانند کربوکاتیون، کربانیون و یا رادیکال آزاد باشند، و یا اینکه واکنش دهنده آلیفاتیک هستن یا آروماتیک به دسته های مختلف (الکتروفیل یا نوکلئوفیل) طبقه بندی می شوند. تشخیص نوع دقیق واکنش شیمیایی، به پیش بینی محصولات نهایی واکنش کمک زیادی می کند. همچنین، به منظور بهینه سازی واکنش های مورد نظر برای شرایط دمایی و یا انتخاب حلال مورد نظر، نیازمند درک صحیحی از نوع واکنش جانشینی هستید. در ادامه مقاله، انواع مختلف این نوع از واکنش ها بررسی می شود.
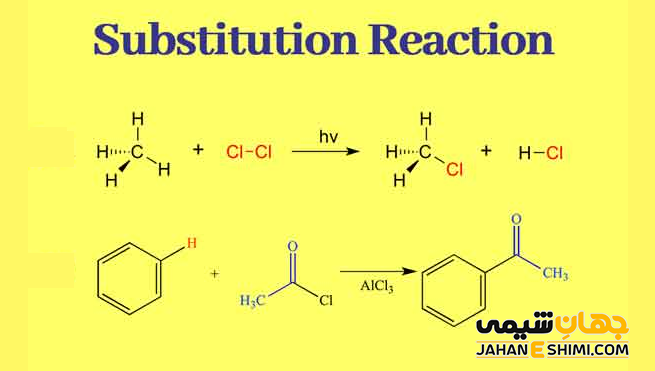
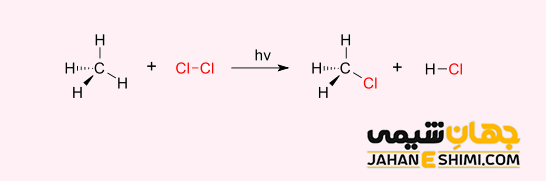
یک مثال خوب از واکنش جانشینی می توان به هالوژناسیون اشاره کرد. هنگامیکه گاز کلر (Cl۲) تحت تابش قرار بگیرد، تعدادی از مولکول های آن به دو رادیکال کلر (•Cl) تبدیل می شوند. الکترون های آزاد آنها به شدت هسته دوست هستند. بنابراین یکی از آنها پیوند کووالانسی C-H را در مولکول متان (CH۴) می شکند. بدین شکل، اتم هیدروژن متان را می گیرد و مولکول HCl خنثی از نظر الکتریکی تشکیل می دهد. رادیکال آزاد دیگر، یک پیوند کووالانسی را با CH۳ تشکیل می دهد تا مولکول متیل کلرید (CH۳Cl) را تشکیل دهد.
واکنش جابهجایی دوگانه
واکنش جانشینی دوگانه (Salt metathesis reaction) که با نام های جایگزینی مضائف یا جابجایی متقابل نیز مشهور است، به واکنشی گفته می شود که در طی آن، دو گونه شیمیایی با یکدیگر مبادله گردند. لازم به ذکر است که در این نوع از واکنش ها، پیوند ها تغییری نمی کنند. به بیان ساده تر، جای دو عنصر در ترکیب شیمیایی با یکدیگر عوض شده است. این نوع واکنش به خصوص در محلول های آبی، متداول است. در حقیقت کاتیون ها و آنیون های دو ماده واکنشگر، یون های مقابل خود را با همدیگر عوض می کنند. شکل عمومی واکنش جانشینی متقابل به صورت زیر است:
AB + CD → AD + CB
واکنش جانشینی دوگانه زمانی انجام می گیرد که محصول واکنش یک رسوب، یک گاز نامحلول و یا الکترولیت ضعیف باشد. بنابراین، واکنش های رسوبی که از مخلوط کردن محلول دو نمک صورت می گیرند و سبب تشکیل یک نمک ناهمگن می شوند، از جمله مهم ترین واکنش های این دسته محسوب می شوند. به علاوه، واکنش های اسید و باز نیز در این دسته قرار می گیرند.

واکنش جابهجایی یگانه
در واکنش جانشینی یگانه، یک یون یا یک اتم از یک ترکیب توسط یون یا اتم واکنش پذیرتر جایگزین می شود. شکل عمومی واکنش جابهجایی یگانه به صورت زیر است:
A + B-C ➝ B + A-C
در این معادله،A یک ترکیب واکنش پذیرتر نسبت به ترکیب B است. بنابراین، اتم یا یون B از مولکول B-C جدا شده و به وسیله A جایگزین می گردد. در این گونه واکنش ها، A و B اغلب فلزات الکترون دهنده یا پروتون هستند. در حالیکه C بیشتر یک عنصر غیر فلزی یا یک آنیون (پذیرنده الکترون) است. مولکول C اغلب به عنوان یک یون ناظر محسوب می شود و در نتیجه در واکنش شرکت نمی کند.

دو نوع واکنش جانشینی یگانه وجود دارد که عبارتند از واکنش جانشینی کاتیونی و واکنش جانشینی آنیونی. در واکنش جانشینی یگانه کاتیونی، یک کاتیون با کاتیون دیگر، جایگزین می شود. این واکنش در دسته واکنش های ردوکس قرار می گیرد. زیرا یک کاتیون الکترون گرفته و کاهش می یابد. در حالیکه همزمان با آن، یک واکنش دهنده دیگر، الکترون داده و اکسید می شود. مثلا واکنش زیر را در نظر بگیرید. در این واکنش، آهن از مس واکنش پذیرتر است.
Fe(s) + CuSO۴(aq) ➝ FeSO۴ + Cu(s)
در واکنش جانشینی یگانه آنیونی، یک آنیون با آنیون دیگر، جایگزین می شود. این واکنش نیز در دسته واکنش های اکسایش- کاهش قرار می گیرد. زیرا به صورت همزمان، کاهش یک واکنش دهنده و اکسایش دیگری وجود دارد. مثلا واکنش زیر را در نظر بگیرید. در این واکنش، برم از ید واکنش پذیرتر است پس جایگزین آن می شود.
Br۲(g) + 2KI(aq) ➝ ۲KBr(aq) + I۲(g)
واکنش جانشینی الکترون دوستی (الکتروفیلی)
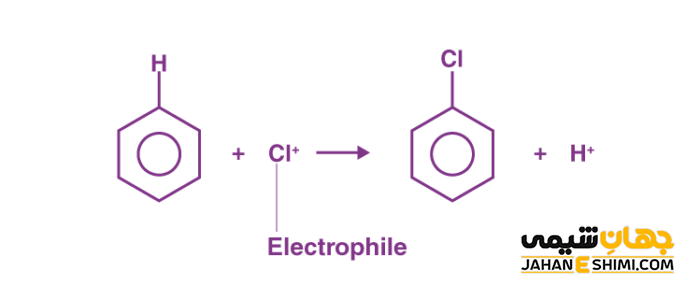
در واکنش های جانشینی الکترون دوستی یا واکنش های جانشینی الکتروفیلی (Electrophilic substitution)، یکی از اتم های مولکول (اغلب اتم هیدروژن) جای خود را با یک اتم یا گروه الکترون دوست (+E) عوض می کند. از مهمترین این نوع واکنش ها می توان به واکنش جانشینی الکترون دوستی آروماتیکی (Electrophilic aromatic substitution) اشاره کرد. این واکنش را به صورت مخفف با SEAr نشان می دهند که در دو مرحله پیش می رود. در مرحله اول، ساختار رزونانس الکترونی حلقه بنزن به وسیله یک الکتروفیل مورد حمله قرار می گیرد. در مرحله دوم، یک پیوند دوگانه شکسته می شود و کربوکاتیون ایجاد می شود. کربوکاتیون ایجاد شده یک پروتون به بیرون پرتاب می کند و یک ترکیب آروماتیک جدید تشکیل می شود. شکل زیر این واکنش را به خوبی نشان می دهد.

توجه داشته باشید که در مرحله اول، با تغییر هیبریداسیون اتم کربن از sp۲ بهsp۳ ، سیستم آروماتیک مسطح از بین می رود. این مرحله به دلیل تشکیل یک کربوکاتیون ناپایدار، از نظر انرژی نا مطلوب است. اما جالب است بدانید که کربوکاتیون حد واسط از طریق رزونانس بار مثبت میان سه اتم کربن حلقه بنزن، پایدار است. در مرحله دوم، پروتون حذف می شود، پس هیبریداسیون اتم کربن مورد نظر دوباره به sp۲ بر می گردد. بدین شکل ساختار مسطح و آروماتیسیتی دوباره در مولکول بوجود می آید. مرحله دوم از نظر انرژی مطلوب است. از این جهت، به عنوان نیروی پیش برنده واکنش کلی محسوب می شود. همانطور که در شکل مشاهده کردید، محصول نهایی این واکنش جابجایی یک بنزن استخلاف شده است.
از جمله مهم ترین انواع جانشینی الکترون دوستی آروماتیکی می توان به نیتروژن دارن کردن آروماتیکی، سولفون دار کردن آروماتیکی، هالوژن دار کردن آروماتیکی، آسیل و آلکیل دار کردن فریدل- کرفتس اشاره کرد.
واکنش جانشینی هسته دوستی (نوکلئوفیلی)
واکنش جانشینی هسته دوستی یا واکنش جانشینی نوکلئوفیلی (Nucleophilic Substitution) به واکنشی گفته می شود که در طی آن، نوکلئوفیل که دارای بار منفی است می تواند جایگزین گروه ترک کننده گردد. این واکنش یکی از واکنش های مهم در شیمی آلی و معدنی محسوب می شود. زیرا بسیاری از ترکیبات مهم آلی با این روش سنتز می شوند. واکنش جابهجایی نوکلئوفیلی در دسته واکنش های گسست ناجور قرار می گیرد. در واقع، در اثر شکستن و یا تشکیل پیوند کووالانسی، جفت الکترون بر روی یکی از اجزای مولکول خواهد بود. این واکنش در فاز محلول انجام می شود. در نتیجه حلال نقش مهمی در انجام آن بازی می کند.
در واکنش جابهجایی هسته دوستی، یک هسته دوست یا نوکلئوفیل (Nucleophile) با بار مثبت یا تا حدی مثبت به طور انتخابی به یک اتم یا گروهی از اتم ها حمله کرده و با آنها پیوند کووالانسی می دهد. بدین شکل جایگزین یک هسته دوست ضعیف تر می شود. سپس گروه نوکلئوفیلی ضعیف تر می تواند به یک گروه ترک کننده (Leaving Group) تبدیل گردد. گروه های ترک کننده می توانند خنثی و یا دارای بار مثبت یا منفی باشند. در این صورت، اتم مثبت یا تا حدی مثبت باقی مانده به الکتروفیل تبدیل خواهد شد. به کل مولکولی که الکتروفیل و گروه خروجی بخشی از آن هستند، بستر می گویند.
در این نوع از واکنش ها، برای راحتی کار، اغلب هسته دوست را با نماد Nu نشان می دهند. به صورت مشابه، گروه های ترککننده را با نماد های X یا LG مشخص می کنند. علاوه بر آن، سه گروه دیگری را که به اتم مرکزی کربن متصل شده اند را با نماد R نشان می دهند. نماد R می تواند نشان دهنده گروه های آلکیلی و یا هیدروژن باشد.
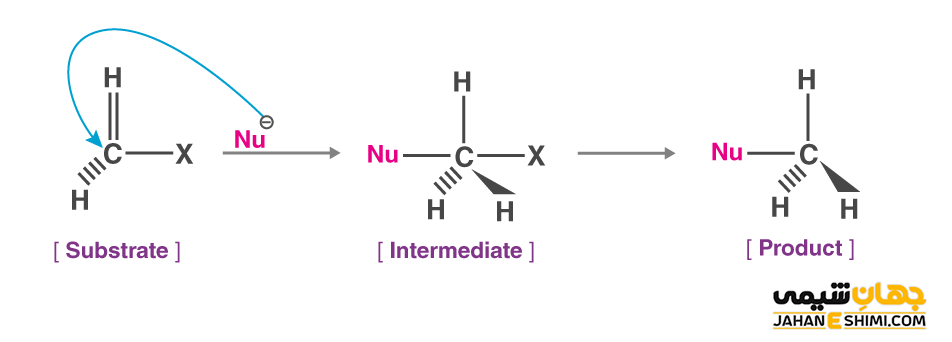
انواع واکنش جانشینی هسته دوستی
این دسته از واکنش ها با توجه به ساختار واکنش دهنده ها از طریق مکانیسم های مختلفی پیش می رود. به عنوان مثال، در شیمی آلی، سه مکانیسم مهم زیر وجود دارد:
- واکنش جانشینی هسته دوستی یک مولکولی (SN۱)
- واکنشِ جابهجایی هسته دوستی دو مولکولی (SN۲)
- واکنش جانشینی هسته دوستی آروماتیک (SN۲Ar)
در شیمی معدنی و شیمی آلی فلزی تنها یک مکانیسم برای این دسته از واکنش ها موجود است. این مکانیسم ها برای شیمی معدنی و شیمی آلی فلزی به ترتیب عبارتند از: واکنش جانشینی هسته دوستی باز مزدوج (SN۱CB) و واکنش انتزاع نوکلئوفیلی. تمرکز ما در ادامه مقاله بر روی واکنش های هسته دوستی در شیمی آلی خواهد بود.
واکنش جانشینی هسته دوستی تک مولکولی
مکانیسم واکنش تفکیکی یا SN۱ شامل دو مرحله است. در مرحله اول، گروه ترک کننده از مولکول جدا شده و کربوکاتیون را تشکیل می دهد. در مرحله دوم، نوکلئوفیل به کربوکاتیون حمله کرده و با آن، یک پیوند سیگمای کووالانسی تشکیل می دهد. این مرحله بسیار سریع اتفاق می افتد. در اینجا، سرعت واکنش فقط به غلظت یکی از مولکول های درگیر در واکنش بستگی دارد. به همین جهت، اصطلاح تک مولکولی برای توصیف آن بکار رفته است. دقت داشته باشید که مرحله تعیین کننده سرعت، همان مرحله تشکیل کربوکاتیون می باشد.
از آنجاییکه گروه ترک کننده قبلا مولکول را ترک کرده است، پس نوکلئوفیل می تواند از هر دو طرف به کربوکاتیون مسطح حمله کند. به بیان دیگر، اگر بستر دارای کربن کایرال باشد، این مکانیسم می تواند منجر به وارونگی استریوشیمی و یا حفظ پیکربندی شود. هر دو محصول اغلب بدون اولویت تشکیل می شوند. در نتیجه محصول واکنش جانشینی هسته دوستی تک مولکولی (Unimolecular nucleophilic substitution) مخلوطی از انانتیومر ها (مخلوط راسمیک) است.
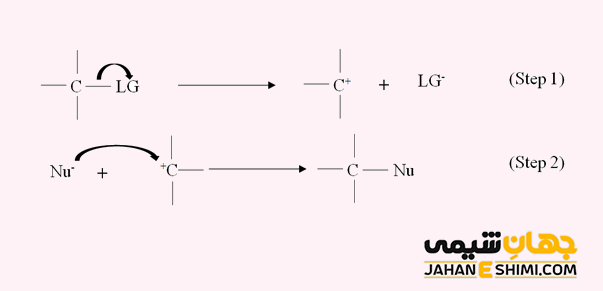
جالب است بدانید که از آنجاییکه تشکیل کربوکاتیون، مرحله تعیین کننده سرعت محسوب می شود، بنابراین هر چه کربوکاتیون ایجاد شده در این مرحله پایدارتر باشد، سرعت واکنش نیز بیشتر خواهد بود. همچنین، هر چه گروه ترک کننده باز ضعیف تری باشد، در اینصورت ترک کننده بهتری نیز خواهد بود. لازم به ذکر است که به دلیل تفکیک پیوند C-X، حلال های پروتیک مانند آب و الکل حلال های مناسب تری محسوب می شوند. زیرا این حلال ها بهتر می توانند یون های مثبت و منفی را حلال پوشی کنند.
واکنش جانشینی هسته دوستی دو مولکولی
مکانیسم واکنش تجمعی یا SN۲ شامل یک مرحله است. حمله نوکلئوفیل و اخراج گروه ترک کننده به طور همزمان اتفاق می افتد. واکنش های جانشینی هسته دوستی دو مولکولی (bimolecular nucleophilic substitution) از نوع درجه دوم یا دو مولکولی محسوب می شوند. یعنی سرعت واکنش از نوع درجه دوم است. این بدین معناست که در مرحله تعیین کننده سرعت واکنش، دو مولکول (هسته دوست و الکترون دوست) در معادله سرعت کلی واکنش وارد می شوند. در نتیجه، سرعت بستگی به غلظت هر دو گونه سوبسترا و نوکلئوفیل دارد. بنابراین افزایش غلظت در هر یک از آن دو، موجب افزایش سرعت واکنش می شود. این مکانیسم همواره منجر به وارونگی پیکربندی می شود. در واقع اگر بستری که تحت حمله هسته دوست قرار می گیرد، کایرال باشد، واکنش منجر به وارونگی استریوشیمی آن می شود که وارونگی والدن نامیده می شود.
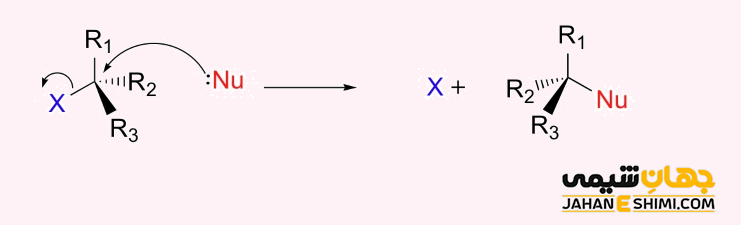
لازم به ذکر است که حلال های آپرتیک (بدون پروتون) قطبی همچون استون حلال مناسب تری برای این دسته از واکنش ها محسوب می شوند. زیرا این حلال ها بهتر می توانند کاتیون را حلال پوشی کنند. در اینصورت، نوکلئوفیل می تواند بدون مزاحمت به سوبسترا حمله کند.
عوامل مؤثر بر جانشینی هسته دوستی دو مولکولی
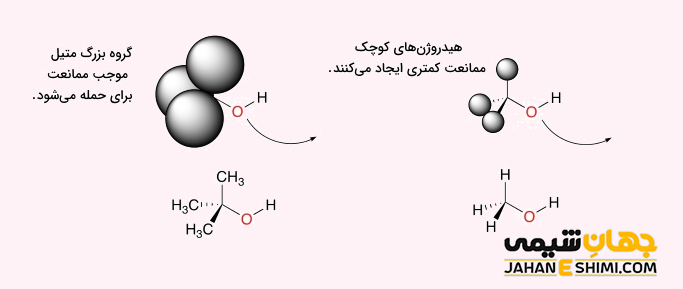
از جمله عوامل مؤثر بر مکانیسم SN۲ می توان به مواردی همچون قدرت هسته دوستی، گروه ترک کننده و ممانعت فضایی اشاره کرد. یکی از عوامل مهم، قدرت هسته دوستی است. عوامل مختلفی همچون حلال، قطبش پذیری و یا قدرت بازی می توانند بر روی قدرت هسته دوستی اثر بگذارند. به طور کلی می توان گفت که با افزایش قدرت بازی، قدرت هسته دوستی نیز زیاد می شود. از طرفی دیگر، هرچه گروه ترک کننده، الکترونگاتیوتر باشد، ترک کننده مناسب تری نیز خواهد بود. لازم به ذکر است که معمولا یک باز قوی، هسته دوست قوی تر و به طور مشابه یک باز ضعیف، گروه ترک کننده بهتری است.
همانطور که بیان شد، در مرحله تعیین کننده سرعت مکانیسم SN۲، نوکلئوفیل به مولکول سوبسترا حمله می کند، پس هرچه در اطراف کربن دارای گروه ترک کننده، ممانعت فضایی کمتری باشد، واکنش نیز سریع تر انجام خواهد شد. می توان گفت که کربن های نوع اول، متیل و غیره واکنش جانشینی SN۲ را بهتر انجام می دهند.
واکنش جانشینی هسته دوستی آروماتیک
زمانیکه سوبسترا یک ترکیب آروماتیک است، نوع واکنش، جانشینی آروماتیک هسته دوستی (Nucleophilic aromatic substitutio) خواهد بود که با مکانیسم های مختلفی رخ می دهد. این نوع واکنش می تواند در سنتز ترکیبات مختلف مفید باشد.