
در علم شیمی، محلول ایده آل (Ideal solution)، به محلولی گفته می شود که خواص ترمودینامیکی شبیه به مخلوطی از گاز های ایده آل از خود نشان دهد. در این محلول، آنتالپی اختلاط برابر با صفر است. دقت داشته باشید که هر چه آنتالپی اختلاط به صفر نزدیکتر باشد، در نتیجه رفتار مخلوط مورد نظر ایده آل تر، خواهد بود. فشار بخار حلال و حل شونده در یک محلول ایده آل رقیق به ترتیب از قانون رائول و قانون هنری پیروی می کنند. در اینصورت، ضریب فعالیت یا ضریب اکتیویته (که انحراف از ایده آل بودن را اندازه می گیرد) برای هر جز، برابر با یک است. محلول ایده آل با نام های محلول آرمانی یا مخلوط ایده آل نیز شناخته می شود. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی محلول ایدهآل پرداخته می شود. لطفا با ما همراه باشید.
محلول چیست؟ علوم هشتم
اگر مخلوطی همگن از دو یا چند ماده شیمیایی تشکیل شده باشد به آن محلول می گویند. محلول ها از دو جز حلال و ماده حل شونده تشکیل می شوند که می توانند به شکل فاز های مختلف جامد، مایع و یا گاز وجود داشته باشند. محلول واقعی یا محلول حقیقی به محلول هایی گفته می شود که در آنها، جسم حل شونده و حلال با همدیگر یک فاز یکنواخت و شفاف تشکیل داده باشند. توجه داشته باشید که تغییری در شفافیت و یا یکنواختی این فاز با گذشت زمان، بوجود نمی آید. در حالیکه، اگر محلولی با گذشت زمان، یكنواختی و شفافیت خود را از دست بدهد، محلول غیر حقیقی خواهد بود، مانند آب گل آلود (سوپانسیون).
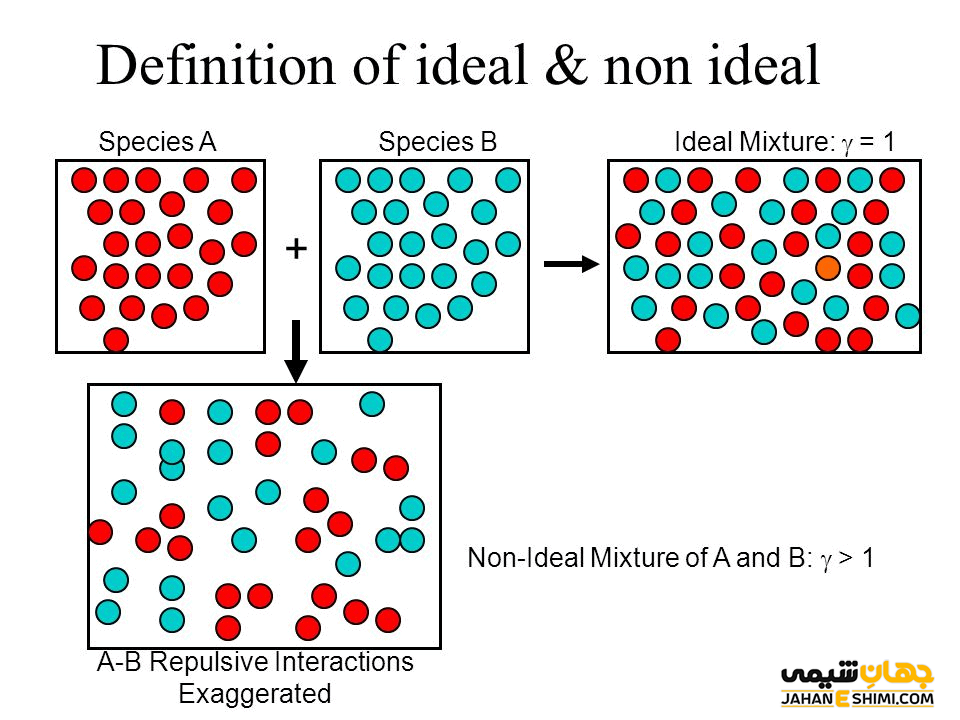
محلول ها را از لحاظ ترمودینامیکی نیز می توان به دو دسته محلول های ایده آل و غیر ایده آل تقسیم کرد. مخلوط ایده ال به محلولی گفته می شود كه در آن، اثرات میان مولكول های هم جنس با اثرات میان مولكول های غیر متجانس، مشابه و در حقیقت یکسان باشد.
لازم به ذکر است که ایده آل بودن یک محلول، ربطی به حقیقی بودن یا غیر حقیقی بودن آن محلول ندارد. زیرا این واژه ها با هم متفاوت هستند. به بیان ساده تر، نمی توان گفت که تمام محلول های واقعی، ایده آل یا غیر ایده آل هستند. به طور کلی می توان گفت که اغلب محلول های واقعی، در عین حال غیر ایده آل نیز می باشند، زیرا انحلال ماده حل شونده می تواند گرمازا یا گرماگیر باشد. اما در عین حال، محلول های حقیقی نیز دارید که ایده آل هم می باشند. به عبارت دیگر، بسیاری از محلول های همگن مواد آلی به طور تقریبی مانند محلول های ایده آل عمل می كنند.
محلول ایده آل
همانطور که بیان شد، ایده آل بودن محلول ها مشابه ایده آل بودن گاز ها است. اما دقت داشته باشید که برهمکنش های بین مولکولی در مایعات قوی هستند، بنابراین نمی توان به سادگی از آنها غفلت کرد. در واقع، برای گاز های ایده آل می توان از برهمکنش های بین مولکولی صرف نظر کرد. بنابراین این تفاوت مهم (برهمکنش های بین مولکولی) میان مخلوط های ایده آل و گازهای ایده آل وجود دارد. در عوض فرض کنید که میانگین قدرت برهمکنش ها میان تمام مولکول های محلول یکسان است.
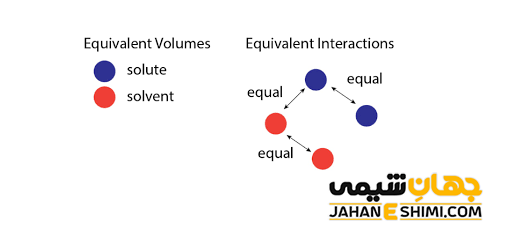
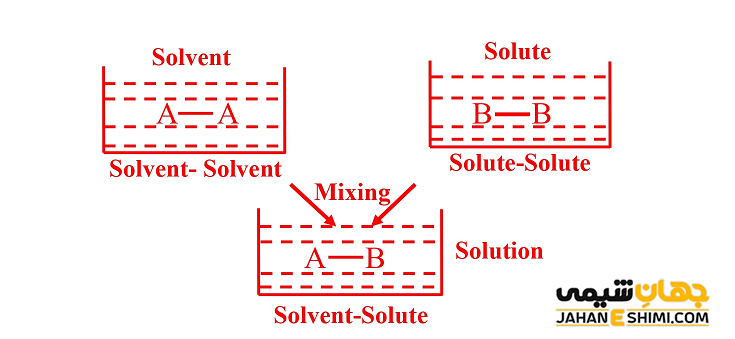
به بیان ساده تر، برای ترکیبی از مولکول های A و B، برهمکنش میان همسایه های غیر مشابه (UAB) و همسایگان مشابه یعنی UAA و UBB باید از قدرت متوسط یکسانی برخوردار باشند (۲UAB = UAA + UBB). علاوه بر آن، برهمکنش های دور بردتر باید صفر و یا حداقل غیر قابل تشخیص باشند. اگر نیرو های مولکولی میان مولکول های AA ،AB و BB یکسان باشند، در اینصورت UAB = UAA = UBB، پس به طور خودکار مخلوط، ایده آل است. در حقیقت در مخلوط های ایده آل، اندازه نیرو های جاذبه بین مولکولی در حالت A-B با نیرو های جاذبه بین مولکولی در اجزا خالص محلول یعنی میان مولکول های A-A و میان مولکول های B-B یکسان است. در نتیجه به هنگام تهیه یک مخلوط ایده آل، هیچ گونه اثر گرمایی مشاهده نخواهد شد.
انحراف از حالت ایده آل
توجه داشته باشید که اگر مولکول ها از نظر شیمیایی تقریبا یکسان باشند، مخلوط به طور تقریبی ایده آل خواهد بود (به عنوان نمونه، ۱- بوتانول و ۲- بوتانول). زیرا در این حالت، برهمکنش بین مولکولی در مایع A (A-A) با مایع B (B-B) قبل از اختلاط با برهمکنش محلول B-A بعد از اختلاط با یکدیگر برابر است. از آنجاییکه انرژی های برهمکنش میان A و B تقریبا برابر و یکسان هستند، در نتیجه تنها یک تغییر کلی بسیار کوچک انرژی (آنتالپی) زمانیکه مواد مخلوط می شوند وجود دارد.
در حالیکه، هر چه ماهیت A و B متفاوت تر باشد، انتظار می رود که مخلوط به شدت از ایده ال بودن منحرف شود.انحراف از حالت ایده ال بودن را می توان با استفاده از توابع مارگولز (Margules functions) یا ضرایب فعالیت توصیف کرد. اگر انحرافات از حالت ایده آل بودن کم باشد، ممکن است یک پارامتر مارگولز برای توصیف ویژگی های مخلوط کافی باشد. چنین مخلوط هایی را محلول منظم می نامند. برخلاف مخلوط های ایدهآل، که حجم ها کاملا قابلیت جمع پذیری دارند و اختلاط همیشه کامل است، حجم یک محلول غیر ایدهآل این گونه نیست.
معادلات مربوط به محلول ایده آل
در مخلوط های ایده آل، هم حلال و هم حل شونده در سراسر گستره کسر مولی از قانون رائول (Raoult’s law) پیروی می کنند، مانند محلول بنزن و تولوئن. بر طبق قانون رائول، فشار بخار يک محلول ايده آل به فشار بخار اجزا شيميايی (به ترکیبات شیمیایی) و کسر مولی اجزا موجود در محلول بستگی دارد. قانون رائول برای محلول های ایدهآل به صورت زیر است:
PA = PA* XA
در این معادله، PA، فشار بخار جز A در محلول، PA*، فشار بخار جز A در حالت خالص و XA، کسر مولی جز A در محلول هستند.
پتانسیل شیمیایی مایعات
رابطه پتانسیل شیمیایی مایعات برای حلال و حل شونده در محلول های ایدهآل از رابطه زیر پیروی می کنند:
μsolutionA = μ∗A + RT lnxA
این رابطه در حقیقت پتانسیل شیمیایی جز A در یک مخلوط ایده آل را به پتانسیل شیمیایی مایع خالص جز A و کسر مولی همان جز در محلول مرتبط می کند. مخلوط های ایده آل می توانند به هر نسبتی در یکدیگر حل شوند.
محاسبه حجم مولی در مخلوط ایده آل
حجم های مولی جزئی در یک مخلوط ایده آل مستقل از ترکیب می باشند. بنابراین، حجم کل در حقیقت مجموع حجم اجزا در شکل خالص آنها خواهد بود.
V = ∑ VA*
محاسبه آنتروپی در مخلوط ایده آل
تغییرات آنتروپی یک محلول ایده آل را می توان به کمک معادله زیر محاسبه کرد.
ΔSmixing = –nR ∑ xi lnxi
محاسبه انرژی گیبس در مخلوط ایده آل
از آنجاییکه آنتالپی انحلال در یک محلول ایده آل برابر با صفر است، پس تغییرات انرژی آزاد گیبس در طی فرآیند انحلال ایده آل ناشی از تغییرات آنتروپی انحلال خواهد بود. از این جهت، تغییرات انرژی آزاد گیبس یک مخلوط ایده آل را می توان به کمک معادله زیر بدست آورد.
ΔGm,mix = RT (xA lnxA + xB lnxB) = ΔGmixing = nRT ∑ xi lnxi
لازم به ذکر است که همیشه مقدار تغییرات انرژی آزاد گیبس در یک مخلوط ایده ال منفی است، زیرا مقادیر لگاریتم موجود در رابطه بالا مقدار منفی دارند.



















