همه چیز در مورد اتم، ساختار اتمها و ذرات تشکیل دهنده آن
اتمها واحد پایه یک عنصر و شکلی از ماده هستند که ممکن است با استفاده از روش های شیمیایی تجزیه نشوند. یک اتم معمولی شامل پروتون، نوترون و الکترون است. هر عنصر فهرست شده در جدول تناوبی از اتم های خاصی تشکیل شده است. هیدروژن، هلیوم، اکسیژن و اورانیوم نمونه هایی از انواع اتم ها هستند.
اتمها بطور کلی سخت و غیر قابل نفوذ هستند یعنی نمی توان آنها را تقسیم کرد. در یونانی پیشوند a به معنی «نیست» و کلمه « tomos» به معنی برش است. بنابراین کلمه اتم از آتوموس آمده است، یک کلمه یونانی به معنی ناگسستنی.
خود اتم از ذرات دیگری به نام پروتون، نوترون و الکترون تشکیل شده است که تعداد آنها در هر عنصری با دیگری متفاوت است. در ادامه مقاله در نشریه جهان شیمی فیزیک توضیحات بیشتری در این رابطه ارائه می گردد لطفا همراه ما باشید.
چگونگی به وجود آمدن اتمها
اتمها پس از بیگ بنگ ۱۳.۷ میلیارد سال پیش ایجاد شدند. با سرد شدن جهان شرایط برای ایجاد کوارک ها و الکترون ها مناسب شد. کوارک ها برای تشکیل پروتون و نوترون گرد هم آمدند و این ذرات به هسته تبدیل شدند.
۳۸۰۰۰۰ سال طول کشید تا جهان به اندازه کافی سرد شود تا سرعت الکترون ها را کاهش دهد و هسته ها بتوانند آنها را برای تشکیل اولین اتم ها جذب کنند. به گفته آزمایشگاه جفرسون اولین اتمها هیدروژن و هلیوم بودند که هنوز فراوان ترین عناصر جهان هستند.
گرانش سرانجام باعث شد ابرهای گازی شکل با هم ادغام شده و ستاره ایجاد کنند و اتم های سنگین تر ( که هنوز هم وجود دارند) در درون ستارگان ایجاد شود و با انفجار ستاره ها (ابر نواختر) به سراسر جهان ارسال شوند.
اتمها چگونه نامگذاری شدند؟
مفهوم اتم در حدود ۴۴۰ قبل از میلاد ایجاد شد. لوسیپوس کلیت این ایده را مطرح کرد. او و دانشجویش دموکریتوس، این ایده را در سال های بعد تصحیح و توسعه دادند. در حال حاضر تقریبا تمام نوشته های اصلی لوکیپوس و دموکریتوس از بین رفته است. در این مورد تنها منابع ما برای ایده های اتمی آنها از نقل قول های نویسندگان دیگر است.
لوسیپوس و دموکریتوس استدلال کردند که ماده از اتم هایی تشکیل شده است که بسیار کوچک و غیرقابل دیدن هستند و همچنین اتمها را نمی توان به قسمت های کوچک تر تقسیم کرد. نام اتم از این نظریه نشأت گرفته است. به عبارت دیگر محدودیت هایی برای تقسیم ماده وجود دارد که ما نمی توانیم از آن فراتر برویم.
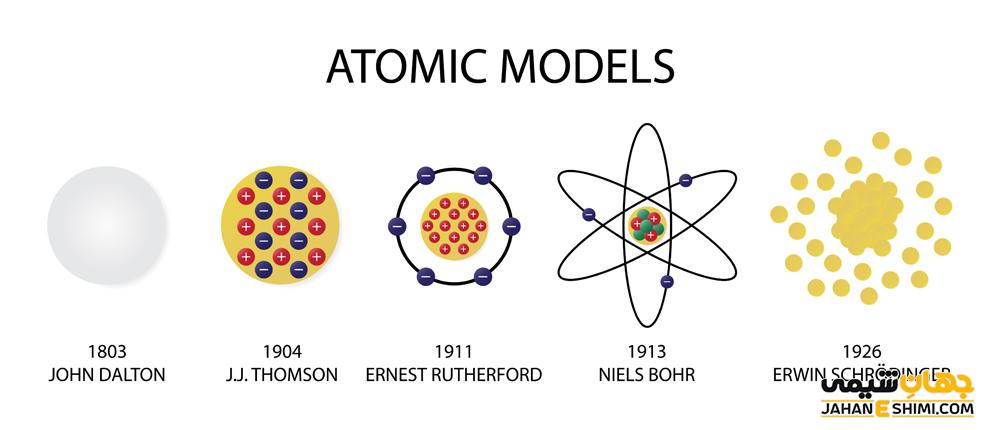
در سال ۱۸۰۳ جان دالتون «نظریه اتمی» ماده را بر اساس آزمایشاتی که وزن عناصر را هنگام تجزیه ترکیبات تعیین می کرد، تدوین کرد. بر اساس شواهد تجربی دالتون پیشنهاد کرد که اتمها به عنوان واحدهای اساسی همه عناصر وجود دارند.
در نهایت فیزیک دانان در قرن بیستم توانستند اتم ها را کاوش کنند و ثابت کنند که آنها در حقیقت غیر قابل تقسیم نیستند. اما اتم هنوز هم از این نظر معنی دارد که کوچکترین و تجزیه ناپذیرین قسمت هر عنصر است و اگر آنها را به اجزا کوچکتر پروتون، نوترون و الکترون تقسیم کنید دیگر عنصر اصلی را نخواهید داشت.
تاریخچه کشف اتمها
نظریه اتمی حداقل ۴۴۰ قبل از میلاد به دموکریتوس، دانشمند و فیلسوف یونانی برمی گردد. توضیحات او شامل ایده هایی بود که اتم ها جدا از یکدیگر وجود دارند و اینکه تعداد بیشماری اتم وجود دارد، آنها قادر به حرکت هستند، می توانند با هم ترکیب شده و ماده را ایجاد کنند اما برای تبدیل شدن به اتم جدید ادغام نمی شوند و نمی توان آنها را تقسیم کرد.
با این حال، از آنجا که اکثر فیلسوف های آن زمان – به ویژه ارسطو به شدت معتقد بودند که تمام ماده از زمین، هوا، آتش و آب ایجاد شده است نظریه اتمی دموکریتوس کنار گذاشته شد.
به گفته گروه شیمی در دانشگاه پردوجان دالتون شیمیدان انگلیسی در سال ۱۸۰۳ هنگامی که نظریه اتمی خود را ارائه کرد آن را بر اساس ایده های دموکریتوس بنا کرد. نظریه دالتون شامل چندین ایده از دموکریتوس بود از جمله اینکه اتمها تجزیه ناپذیرند و برای ایجاد یک ماده باهم ادغام می شوند.
ایده هایی که دالتون به این نظریه اضافه کرد عبارتند از اینکه همه اتم های یک عنصر خاص یکسان هستند، اتم های یک عنصر دارای وزن و ویژگی های متفاوتی نسبت به اتمهای یک عنصر دیگر هستند، اتم ها نمی توانند ایجاد یا نابود شوند.
تامسون، فیزیکدان انگلیسی که الکترون را در سال ۱۸۹۷ کشف کرد ثابت کرد که می توان اتم ها را تجزیه کرد. او با مطالعه خواص تخلیه الکتریکی در لوله های پرتو کاتدی توانست وجود الکترون ها را تعیین کند. بر اساس مقاله ۱۸۹۷ تامسون، اشعه هایی که در داخل لوله منحرف شده اند ثابت می کند چیزی در لوله خلاء بار منفی دارد.
در سال ۱۸۹۹ تامسون شرح نسخه اتم خود را منتشر کرد که معمولا به عنوان «مدل پودینگ آلو» شناخته می شود. گزیده ای از این مقاله درسایت تیم شیمی یافت می شود. مدل اتم تامسون شامل تعداد زیادی الکترون معلق در چیزی بود که بار مثبت تولید می کرد و به اتم یک بار کلی خنثی می داد. مدل او شبیه پودینگ آلو بود، یک دسر محبوب انگلیسی که کشمش را در یک توپ گرد مانند کیک معلق کرده بود.
به گفته دپارتمان شیمی در دانشگاه پردو، دانشمند بعدی که مدل اتمی را بیشتر اصلاح و پیش برد رادرفورد بود که زیر نظر تامسون تحصیل می کرد . در سال ۱۹۱۱ رادرفورد نسخه اتم خود را منتشر کرد که شامل هسته ای با بار مثبت بود که الکترون ها به دور آن می چرخیدند. این مدل زمانی بوجود آمد که رادرفورد و دستیارانش ذرات آلفا را به ورقه های نازک طلا شلیک کردند. به گفته آزمایشگاه جفرسون یک ذره آلفا از دو پروتون و دو نوترون تشکیل شده است که همگی توسط یک نیروی هسته ای قوی که هسته را تشکیل می دهد در کنار هم نگه داشته شده اند.
دانشمندان متوجه شدند که درصد کمی از ذرات آلفا در زوایای بسیار بزرگ در جهت حرکت اصلی پراکنده شده اند در حالی که اکثریت آنها به سختی از مسیر خود عبور می کنند. رادرفورد توانست اندازه هسته اتم طلا را تقریبا تخمین بزند و آن را حداقل ۱۰ هزار برابر کوچکتر از اندازه کل اتم دانست و بیشتر اتم از فضای خالی تشکیل است. مدل اتم رادرفورد هنوز مدل اصلی است که امروزه مورد استفاده قرار می گیرد.
دانشمندان دیگری که مدل اتمی را تقویت کردند نیلز بور (بر اساس مدل رادرفورد که شامل خواص الکترون ها بر اساس طیف هیدروژن است)، اروین شرودینگر (مدل کوانتومی اتم را توسعه داد)، ورنر هایزنبرگ (اظهار داشت که نمی توان هر دو موقعیت و سرعت یک الکترون را به طور همزمان مشخص کرد) و موری گل مان و جورج زویگ (به طور مستقل این نظریه را توسعه دادند که پروتون ها و نوترون ها از کوارک ها تشکیل شده اند).
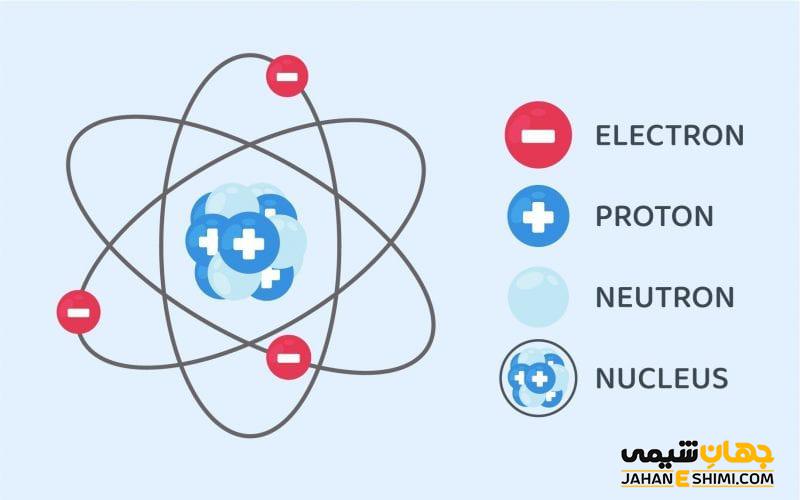
ذرات اتمی
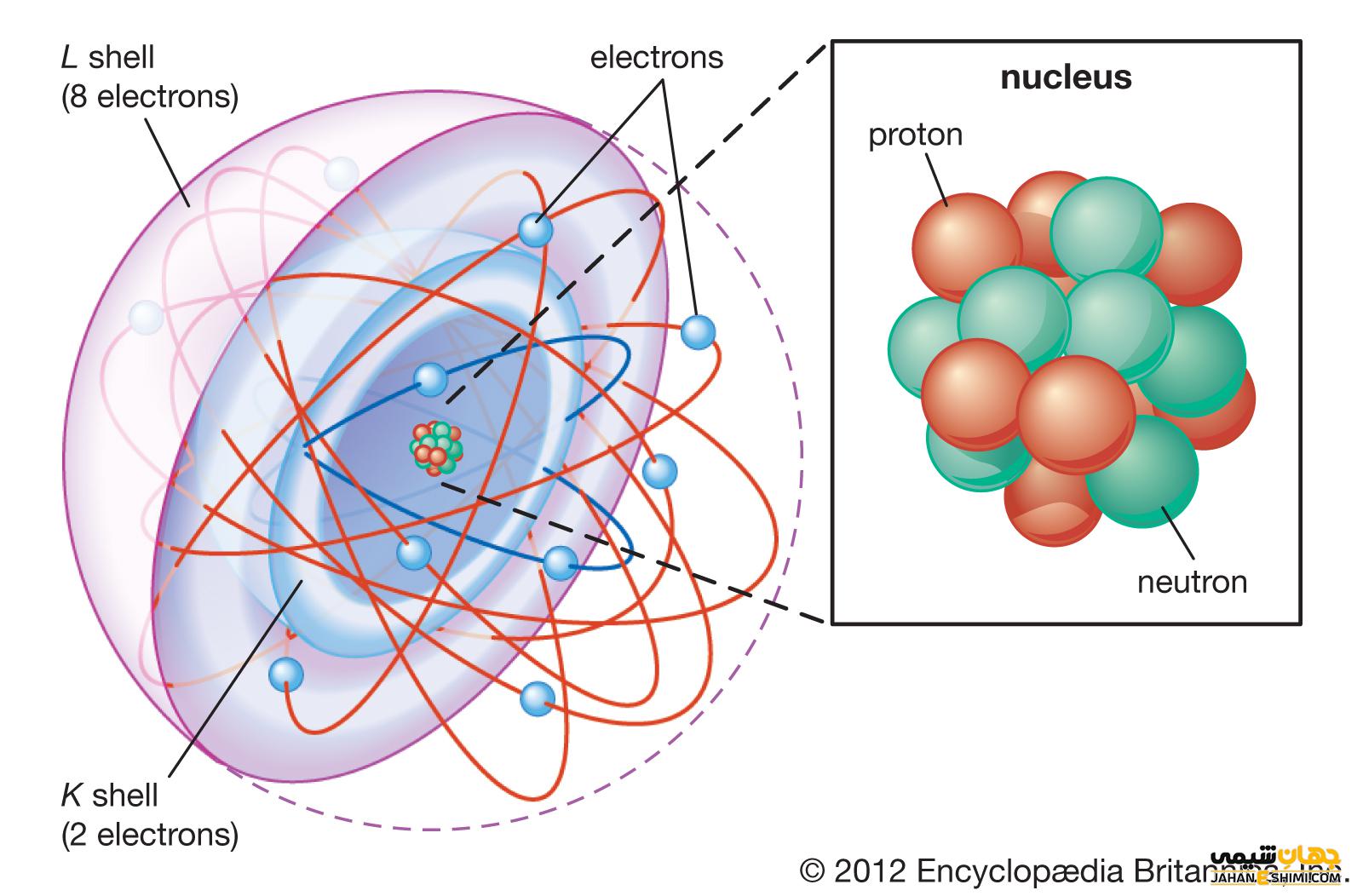
پروتون ها و نوترون ها سنگین تر از الکترون ها هستند و در هسته در مرکز اتم قرار دارند. الکترون ها بسیار سبک هستند و به شکل ابری در حال گردش به دور هسته وجود دارند. به گفته آزمایشگاه ملی لوس آلاموس، شعاع ابر الکترونیکی ۱۰ هزار برابر بیشتر از هسته است .
جرم پروتون ها و نوترون ها تقریبا یکسان است. با این حال جرم یک پروتون حدود ۱۸۳۵ برابر بیشتر از یک الکترون است. تعداد اتمها همیشه برابر پروتون و الکترون است و تعداد پروتون ها و نوترون ها نیز معمولا یکسان است. افزودن پروتون به اتم باعث ایجاد یک عنصر جدید می شود در حالی که افزودن نوترون ایزوتوپ یا نسخه سنگین تر آن اتم را ایجاد می کند.
هسته
هسته در سال ۱۹۱۱ توسط ارنست رادرفورد، فیزیکدان نیوزلندی کشف شد. در سال ۱۹۲۰ رادرفورد نام پروتون را برای ذرات دارای بار مثبت اتم پیشنهاد کرد. وی همچنین نظریه ای مبنی بر وجود یک ذره خنثی در داخل هسته داشت که جیمز چادویک، فیزیکدان انگلیسی و دانشجوی رادرفورد، در سال ۱۹۳۲ توانست آن را تایید کند.
طبق Chemistry LibreTexts تقریبا تمام جرم یک اتم در هسته آن قرار دارد. پروتون ها و نوترون هایی که هسته را تشکیل می دهند تقریبا جرم یکسانی دارند (پروتون کمی کمتر است) و حرکت زاویه ای یا چرخش یکسانی دارند.
هسته توسط یک نیروی قوی یعنی جاذبه، یکی از چهار نیروی اساسی در طبیعت کنار هم نگه داشته می شود. این نیرو بین پروتون ها و نوترون ها بر نیروی الکتریکی دافعه غلبه می کند در غیر این صورت پروتون ها را با توجه به قوانین الکتریسیته از هم دور می کند.
برخی از هسته های اتمی ناپایدار هستند زیرا نیروی اتصال برای اتم های مختلف بر اساس اندازه هسته متفاوت است. این اتمها سپس به عناصر دیگر تجزیه می شوند، مانند کربن ۱۴ که به نیتروژن ۱۴ تجزیه می شود.
پروتون ها
پروتون ها ذراتی با بار مثبت هستند که در هسته های اتمی یافت می شوند. رادرفورد آنها را در آزمایش هایی با لوله های اشعه کاتدی که بین سال های ۱۹۱۱ تا ۱۹۱۹ انجام شده بود، کشف کرد.
تعداد پروتون های یک اتم برای هر عنصر منحصر به فرد است. برای مثال اتم های کربن دارای شش پروتون، اتم های هیدروژن دارای یک و اتم های اکسیژن دارای هشت پروتون هستند. تعداد پروتون های یک اتم را عدد اتمی آن عنصر می نامند. تعداد پروتون ها رفتار شیمیایی عنصر را تعیین می کند. عناصر در جدول تناوبی به ترتیب افزایش عدد اتمی مرتب شده اند .
سه کوارک هر پروتون را تشکیل می دهد- دو کوارک بالا (هر کدام دارای دو سوم بار مثبت) و یک کوارک پایین (با یک سوم بار منفی)- که توسط ذرات زیر اتمی دیگری به نام گلوئون ها در کنار هم نگه داشته می شوند که فاقد جرم هستند.
الکترون ها
الکترون ها در مقایسه با پروتون ها و نوترون ها بسیار ریز هستند و بیش از ۱۸۰۰ برابر کوچک تر از پروتون یا نوترون هستند. به گفته آزمایشگاه جفرسون، الکترونها ۰.۰۵۴ درصد نوترون ها جرم دارند.
جوزف جان (جی جی) تامسون، فیزیکدان انگلیسی الکترون را در سال ۱۸۹۷ کشف کرد . الکترون ها که در ابتدا با نام «پیکره» شناخته می شدند دارای بار منفی بوده و از نظر الکتریکی به پروتون های دارای بار مثبت جذب می شوند.
الکترون ها هسته اتمی را در مسیرهایی به نام اوربیتال احاطه کرده اند، ایده ای که اروین شرودینگر، فیزیکدان اتریشی در دهه ۱۹۲۰ مطرح کرد. امروزه این مدل به عنوان مدل کوانتومی یا مدل ابر الکترونی شناخته می شود. مدارهای داخلی که اتم را احاطه کرده اند کروی هستند اما مدارهای بیرونی بسیار پیچیده تر هستند.
پیکربندی الکترونی اتم به مکان الکترون ها در یک اتم معمولی اشاره دارد. به گفته آزمایشگاه ملی لوس آلاموس، شیمی دانان با استفاده از پیکربندی الکترون و اصول فیزیک می توانند خواص یک اتم مانند ثبات، نقطه جوش و رسانایی را پیش بینی کنند.
نوترون ها
به گفته انجمن فیزیک آمریکا وجود نوترون توسط رادرفورد در سال ۱۹۲۰ نظریه پردازی شد و توسط چادویک در سال ۱۹۳۲ کشف شد . نوترون ها در حین آزمایش هنگامی که اتم ها به ورقه نازکی از بریلیوم شلیک می شدند، کشف شدند
نوترون ها ذرات بدون بار هستند که در تمام هسته های اتمی (به استثنای هیدروژن) یافت می شوند. جرم نوترون کمی بیشتر از پروتون است. مانند پروتون ها، نوترون ها نیز از کوارک ها ساخته شده اند-یک کوارک بالا (با بار مثبت ۲/۳) و دو کوارک پایین (هر کدام دارای بار منفی یک سوم).
یون ها
اتمها زمانی پایدار می مانند که در سطح خارجی مدار کامل الکترونی داشته باشند. برای پرکردن بیرونی ترین پوسته خود، یک اتم الکترون می دهد، می گیرد یا به اشتراک می گذارد. هنگامی که یک اتم الکترون دریافت می کند یا از دست می دهد، یک یون ایجاد می شود .
یونها دارای بار الکتریکی مثبت یا منفی هستند. اتمی با تعداد پروتون و الکترون یکسان، بار کلی ندارد بنابراین اگر الکترون منفی از دست بدهد، پروتون بیشتری خواهد داشت و بار مثبت دارد.
یونهای دارای بار مثبت کاتیون نامیده می شوند. اگر اتم الکترون بدست آورد. اگر اتم الکترون بدست آورد الکترون های بیشتری وجود خواهد داشت و بار منفی خواهد داشت. آنیون ها یون هایی هستند که بار منفی دارند.
مولکول ها
در قسمت قبل گفتیم که بسیاری از اتم ها وقتی بار خالص دارند پایدارتر هستند. آنها به عنوان یون پایدارتر هستند. هنگامی که یک کاتیون به آنیون نزدیک می شود به دلیل بارهای خالص متفاوت به هم متصل می شوند – بارهای مثبت بارهای منفی را جذب می کنند و برعکس.
وقتی دو یا چند اتم به هم متصل می شوند یک مولکول ایجاد می کنند. به عنوان مثال یک مولکول آب از دو اتم هیدروژن (H) و یک اتم اکسیژن (O) ساخته شده است. جرم مولکولی مجموع تمام اتمهای موجود در مولکول است. مجموعه ای از مولکول ها را ترکیب می نامند.
مدل اتمی
یک ماده شامل تجمع مولکول ها است که می توان آنها را به راحتی جدا کرد. مولکول ها به نوبه خود از اتمهایی تشکیل شده اند که با پیوندهای شیمیایی به هم متصل شده اند و تجزیه آنها دشوار است. هر اتم از ذرات کوچک تر – یعنی الکترون ها و هسته ها – تشکیل شده است.
این ذرات دارای بار الکتریکی هستند و نیروهای الکتریکی مسئول نگه داشتن اتم در کنار یکدیگر هستند. تلاش برای جداسازی این ذرات کوچک به مقدار فزاینده ای انرژی نیاز دارد و منجر به ایجاد ذرات جدید زیر اتمی می شود که بسیاری از آنها دارای بار هستند.
یک اتم عمدتا از فضای خالی تشکیل شده است. هسته مرکز بار مثبت یک اتم است و بیشتر جرم آن را شامل می شود. هسته از پروتون هایی که بار مثبت دارند و نوترون هایی که بار ندارند، تشکیل شده است.
پروتون ها، نوترون ها و الکترون های اطراف آنها ذرات با عمر طولانی هستند که در تمام اتمهای معمولی و طبیعی وجود دارند. سایر ذرات زیر اتمی ممکن است در ارتباط با این سه نوع ذره یافت شوند. با این حال آنها می توانند تنها با افزودن مقدار زیادی انرژی ایجاد شوند و عمر بسیار کوتاهی دارند.
همه اتم ها تقریبا یک اندازه هستند حتی اگر دارای ۳ یا ۹۰ الکترون باشند. اندازه تقریبی ۵۰ میلیون اتم ماده جامد در یک ردیف ۱ سانتی متر (۰.۴ اینچ) است. پروتون ها ذرات عظیم و دارای بار مثبت هستند، در حالی که نوترون ها بار ندارند و جرم کمتری از پروتون ها دارند.
این واقعیت که هسته بین ۱ تا ۳۰۰ پروتون و نوترون داشته باشند، تغییرات وسیع جرم آنها را نشان می دهد. سبک ترین هسته یعنی هیدروژن ۱۸۳۶ برابر جرم بیشتری نسبت به یک الکترون دارد در حالی که هسته های سنگین تقریبا ۵۰۰۰۰۰ برابر جرم بیشتری دارند.
خواص اساسی اتمها
عدد اتمی
مهمترین ویژگی یک عنصر عدد اتمی آن است (معمولا با حرف Z نشان داده می شود ) که به عنوان تعداد واحدهای بار مثبت (پروتون ها) در هسته تعریف می شود. به عنوان مثال اگر اتم دارای Z ۶ باشد کربن است در حالی که Z ۹۲ مربوط به اورانیوم است .
یک اتم خنثی دارای تعداد مساوی پروتون و الکترون است به طوری که بارهای مثبت و منفی دقیقا متعادل می شوند. از آنجا که این الکترون ها هستند که نحوه تعامل یک اتم با اتمی دیگر را تعیین می کنند، در نهایت این تعداد پروتون در هسته است که ویژگی های شیمیایی یک اتم را تعیین می کند.
جرم اتمی و ایزوتوپ ها
تعداد نوترون های یک هسته بر جرم اتم تاثیر می گذارد اما بر خواص شیمیایی آن تاثیر نمی گذارد. بنابراین یک هسته با شش پروتون و شش نوترون دارای خواص شیمیایی مشابه یک هسته با شش پروتون و هشت نوترون خواهد بود اگرچه این دو جرم متفاوتی خواهند داشت.
گفته می شود هسته هایی با تعداد پروتون های یکسان اما تعداد نوترون های مختلف ایزوتوپ یکدیگر هستند. همه عناصر شیمیایی ایزوتوپ های زیادی دارند. معمولا توصیف ایزوتوپ های مختلف با مشخص شدن مجموع تعداد پروتون ها و نوترون ها در هسته است.
جرم اتم
جرم اتم ها بر حسب واحد جرم اتمی، تعریف شده است که به ۱/۱۲ از جرم یک اتم کربن ۱۲ یا ۱.۶۶۰۵۳۸۹۲۱ × ۱۰ -۲۴ گرم است. از آنجا که الکترون ها در مقایسه با پروتون ها و نوترون ها کوچک تر هستند، تعداد پروتون ها به علاوه نوترون ها به اتم جرم می دهد. همه اتم های یک عنصر معین همیشه دارای پروتون یکسانی هستند اما ممکن است از نظر تعداد نوترون های موجود در هسته متفاوت باشند.
پیوندهای اتمی
سه روش اساسی وجود دارد که الکترون های خارجی اتم ها می توانند پیوند ایجاد کنند:
- الکترون ها را می توان از اتمی به اتم دیگر منتقل کرد.
- الکترون ها را می توان بین اتم های مجاور تقسیم کرد.
- الکترون ها را می توان با تمام اتم های یک ماده به اشتراک گذاشت
پیوند یونی
انتقال الکترون از اتمی به اتم دیگر باعث تشکیل پیوند یونی می شود. به عنوان مثال یک اتم سدیم را در نظر بگیرید که دارای یک الکترون در دورترین مدار خود است و به اتم کلر نزدیک می شود که دارای هفت الکترون است. از آنجا که برای پر کردن بیرونی ترین پوسته این اتم به هشت الکترون نیاز است. اتم سدیم الکترون تک ظرفیتی خود را برای پر کردن مدار کلر اهدا می کند و یک مولکول کلرید سدیم را با سطح انرژی پایین تر تشکیل می دهد.
اتمی که تعداد الکترون های مدار آخر آن بیشتر از تعداد پروتون ها در هسته باشد یون نامیده می شود. هنگامی که الکترون لایه ظرفیت سدیم از دست می رود یون بار مثبت خواهد داشت . به طور همزمان اتم کلر با دریافت یک الکترون اضافی بار منفی به خود می گیرد و به یون کلر تبدیل می شود. نیروی الکتریکی بین این دو یون با بار مخالف آنها را به هم قفل می کند و پیوند یونی نامیده می شود . ترکیب کلرید سدیم به دست آمده یک کریستال مکعب است که معمولا به نمک معمولی سفره معروف است.
پیوند کووالانسی
دومین استراتژی پیوند ذکر شده در بالا توسط مکانیک کوانتومی توصیف شده است. هنگامی که دو اتم به یکدیگر نزدیک می شوند، می توانند یک جفت الکترون خارجی را به اشتراک بگذارند (تصور کنید که اتم ها الکترون ها را بین خود به عقب و جلو پرتاب می کنند) پیوند کووالانسی بوجود می آید. پیوندهای کووالانسی به ویژه در مواد آلی رایج است، جایی که مولکول ها اغلب دارای زنجیره های طولانی اتم های کربن هستند (که چهار الکترون در پوسته های ظرفیت خود دارند).
سرانجام در برخی مواد، هر اتم یک الکترون بیرونی به اشتراک می گذارد که آزادانه شناور می شود در اصل، الکترون با تمام اتم های درون ماده مشترک است. الکترون ها نوعی دریا تشکیل می دهند که در آن یون های مثبت شناور هستند. این پیوند، فلزی نامیده می شود و همانطور که از نامش پیداست همان چیزی است که فلزات را در کنار هم نگه می دارد.
پیوند واندروالس
در نهایت، راهی برای ایجاد پیوند ضعیف بین دو اتم خنثی الکتریکی وجود دارد. فیزیکدان هلندی یوهانس ون در والس برای اولین بار مکانیسم چنین پیوندی را در سال ۱۸۷۳ نظریه پردازی کرد و اکنون به نیروهای ون در والس معروف است.
وقتی دو اتم به یکدیگر نزدیک می شوند ابرهای الکترونیکی آنها نیروهای دافعه ای بر یکدیگر وارد می کنند به طوری که اتم ها قطبی می شوند. در چنین شرایطی ممکن است جاذبه الکتریکی بین هسته یک اتم و الکترون های اتم دیگر بر نیروهای دافعه بین الکترون ها غلبه کند و پیوند ضعیفی ایجاد شود.
یک نمونه از این نیرو را می توان در گرافیت معمولی مشاهده کرد که اتم های کربن در صفحاتی با پیوندهای کووالانسی قوی در کنار هم نگه داشته می شوند، اما ورقه ها تنها توسط نیروهای وان در والس در کنار هم نگه داشته می شوند. وقتی مدادی روی کاغذ کشیده می شود، نیروهای ون در والس می شکنند و ورقه های کربن از بین می روند. این همان چیزی است که خط تیره مداد را ایجاد می کند.

فهرست نظریه های اتمی
در ادامه برخی از شناخته شده ترین نظریه های اتمی را بررسی می کنیم.
باورهای یونان باستان
همه مواد از واحدهای کوچکی به نام اتم تشکیل شده اند. این نظریه اولین بار توسط لوکیپوس و دموکریتوس در قرن پنجم قبل از میلاد پیشنهاد شد که همه ماده از واحدهای کوچکی به نام اتم ساخته شده است.
علاوه بر این، آنها می گویند که این ذرات جامد بدون ساختار داخلی بوده و در اشکال و اندازه های مختلف وجود دارند و برخی از ویژگی های نامحسوس مانند طعم و رنگ را ایجاد کردند.
نظریه اتمی دالتون
شیمیدان انگلیسی جان دالتون متعاقبا مفهوم یونانی اتم ها را در سال ۱۸۰۸ مطرح کرد. او تصور کرد که ماده از اتم ها تشکیل شده است که ذرات کوچک تقسیم ناپذیری هستند. او همچنین پیشنهاد کرد که در حالی که همه اتم های یک عنصر یکسان هستند اما کاملا با اتم هایی که عناصر دیگر را تشکیل می دهند، متفاوت هستند.
نظریه تامسون
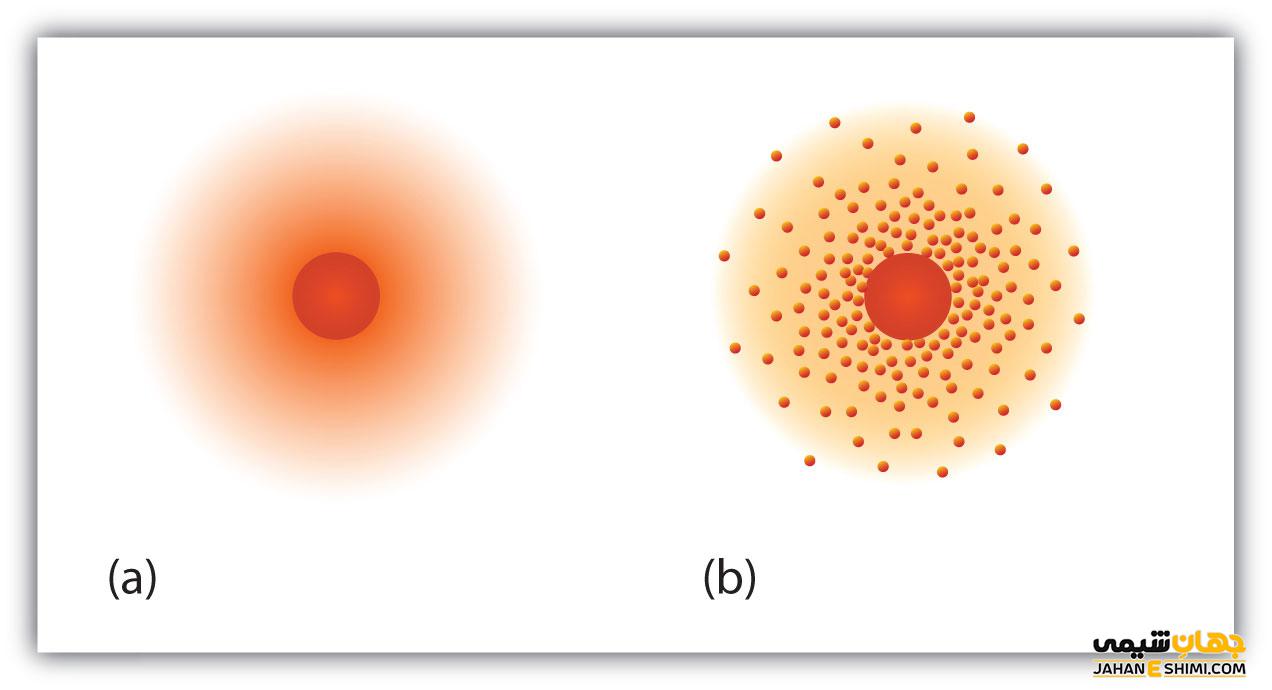
در سال ۱۹۰۴ فیزیکدان انگلیسی جوزف جی تامسون نظریه «پودینگ آلو» یا تم قابل تقسیم را ارائه کرد. او این کار را پس از کشف الکترون ها در ۱۸۹۷ انجام می دهد.همچنین او پیشنهاد کرد که اتم ها شامل یک کره بزرگ با بار مثبت مملو از الکترون های دارای بار منفی مانند میوه های داخل پودینگ آلو هستند.
فرضیه رادرفورد
در سال ۱۹۱۱ ارنست رادرفورد (فیزیکدان انگلیسی) یک مدل هسته ای برای اتم ها پیشنهاد کرد. اتمی که در آن هسته وجود دارد. در گذشته او بخشی از فعالیت حرکت پروتون ها و الکترون ها را در قسمت مرکزی اتم کشف کرد. وی در ادامه فرض کرد که تعداد پروتون ها و الکترون ها در یک اتم برابر است.
نظریه بور
در سال ۱۹۱۳ نیلز بور فیزیک دان دانمارکی مدلی سیاره ای را پیشنهاد کرد که نشان می داد الکترون ها درست هنگام گردش سیارات به دور خورشید به دور هسته می چرخند. هنگامی که الکترون ها در مدار هستند دارای «انرژی ثابت» هستند.
وقتی این اتمها انرژی را جذب کرده و به مدار بالاتر می روند این نظریه از آنها به عنوان الکترون های «برانگیخته» یاد می کند. در زمان بازگشت به مدار اصلی خود این انرژی را به عنوان تابش الکترومغناطیسی رها می شود.
انیشتین، هایزنبرگ و مکانیک کوانتومی
در مورد نظریه های قبلی اتم شامل یک هسته مرکزی و سنگین است که توسط تعدادی الکترون احاطه شده است. نظریه های قبلی الکترون ها و سایر ذرات ریز را به عنوان توده های جامد ثابت در نظر می گرفتند.
از سوی دیگر نظریه کوانتومی مدرن آنها را به عنوان «ابر» مشخص می کند. علاوه بر این می توان سرعت آنها را دقیقا همراه با مکان آنها اندازه گیری کرد. با این حال ما نمی توانیم اینکار را همزمان انجام دهیم.
اتم چگونه کشف شد
اولین ایده های مهم کشف اتم به یونانیان باستان در قرن پنجم قبل از میلاد، به ویژه ایده های فیلسوفان لوکیپوس و دموکریتوس بر می گردد. (شواهدی وجود دارد که نشان می دهد فلاسفه در هند و چین تقریباً در همان زمان حدس های مشابهی در این رابطه داشته اند.) آنها این سؤال را بررسی کردند که آیا می توان یک ماده را بدون محدودیت به قطعات کوچک تر تقسیم کرد یا خیر. تنها چند پاسخ ممکن برای این سوال وجود دارد. یکی اینکه تقسیم بی نهایت کوچک ممکن است. مورد دیگر آن چیزی است که به ویژه دموکریتوس معتقد بود – اینکه کوچکترین واحدی وجود دارد که نمی توان آن را بیشتر تقسیم کرد. دموکریتوس این واحد را اتم نامید. اکنون می دانیم که خود اتم ها را نیز می توان تقسیمب ندی کرد، اما هویت آنها در این فرآیند از بین می رود، بنابراین یونانی ها از یک جهت درست می گفتند. یونانیان همچنین احساس می کردند که اتم ها در حرکت ثابت هستند، تصور درست دیگری که بعدا ثابت شد.
یونانی ها و دیگران در مورد خواص اتم ها حدس و گمان می زدند و پیشنهاد می کردند که فقط چند نوع وجود دارد و همه مواد به صورت ترکیب های مختلفی از این انواع تشکیل شده است. این پیشنهاد معروف که عناصر اساسی خاک، هوا، آتش و آب است، بسیار درخشان، اما نادرست بود. یونانی ها رایج ترین نمونه های چهار حالت ماده (جامد، گاز، پلاسما و مایع) را به جای عناصر اصلی شناسایی کردند. اولین شواهد واقعا مستقیم از اتم ها به رابرت براون، گیاه شناس اسکاتلندی نسبت داده می شود.
در سال ۱۸۲۷، او متوجه شد که دانه های گرده ریز معلق در آب ساکن در مسیرهای پیچیده حرکت می کنند. این را می توان با میکروسکوپ برای هر ذره کوچک در یک سیال مشاهده کرد. این حرکت ناشی از حرکات حرارتی تصادفی مولکول های سیال است که با ذرات سیال برخورد می کنند و اکنون به آن حرکت براونی می گویند. این آلبرت انیشتین بود که در سال ۱۹۰۵، مقالات متعددی را منتشر کرد که دقیقاً توضیح میدادند چگونه میتوان از حرکت براونی برای اندازه گیری اندازه اتمها و مولکولها استفاده کرد.



















