
در علم شیمی کلوئید یا چسب سان (colloid) به مخلوط ناهمگنی گفته می شود که ذرات پراکنده در آن، از لحاظ اندازه، میان محلول ساده و سوسپانسیون قرار می گیرند. به بیان دیگر، ذرات کلوئید از ذرات محلول بزرگتر هستند، پس در مایع حل نمی شوند. از طرف دیگر، از ذرات سوسپانسیون ریزتر می باشند، پس ته نشین هم نمی شوند. به عنوان مثال، شیر را در نظر بگیرید. چربی شیر، نه به صورت محلول و نه به صورت ته نشین است، بلکه به صورت معلق در فاز مایع می باشد. به بیان ساده تر می توان گفت که چسب سان از دو ماده مختلف تشکیل شده است که این دو ماده با هم مخلوط می شوند، اما در یکدیگر حل نخواهند شد. در ادامه این مقاله در نشریه جهان شیمی فیزیک به بررسی کلوئید و انواع مختلف آن می پردازیم. لطفا با ما همراه باشید.
تاریخچه
مطالعات و تحقیقات شیمیدان برجسته اسکاتلندی، توماس گراهام (Thomas Graham) بر روی فرآیند دیالیز، منجر به یافته ها و نتایج مهمی درباره مواد کلوئیدی شد. در واقع، او اولین کسی بود که مخلوطی مانند مخلوط نشاسته در آب و یا ژلاتین را یک کلوئید نامید. گراهام اصطلاح “اجسام چسب مانند” را برای نخستین بار در سال ۱۸۶۱ میلادی استفاده کرد و به ترویج آن پرداخت. واژه کلوئید در حقیقت ریشه ای یونانی دارد و از ترکیب دو کلمه یونانی کلا (Kolla) به معنای چسب و ئیدوس (Eidos) به معنای شبیه بدست آمده است. اقدامات گراهام، باعث پیدایش شاخه ای جدید از علم شیمی با نام شیمی کلوئیدی شد. سال ها بعد یعنی در سال ۱۹۵۸ میلادی، رئیس سابق انجمن صنایع شیمیایی یعنی سر اریک ریدال، انجمن شیمی کلوئیدی را تشکیل داد.

کلوئید چیست شیمی دوازدهم
یک کلوئید از ذرات ریز یک ماده شیمیایی که در ماده ای دیگر پخش شده است، بدست می آید. از تعریف بالا می توان این چنین استنباط کرد که مانند یک محلول که از دو جزء حل شونده و حلال تشکیل شده است، کلوئید ها نیز از دو فاز پراکنده و پیوسته تشکیل می شوند. فاز پراکنده شونده یا فاز پخش شونده (Dispersed Phase)، به ماده معلق در مخلوط گفته می شود (اجزایی که به صورت کلی در مقادیر کم وجود دارند). در حالیکه فاز پیوسته، پراکنده کننده یا پخش کننده (Dispersion Medium)، هسته اصلی مخلوط را تشکیل می دهد (فضایی از مخلوط که اجزای فاز پراکنده در آن پخش شده اند).
لازم به ذکر است که پراکندگی ذرات در کلوئید ها به شکل پراکندگی یونی یا مولکولی نیست. در واقع به صورت مجموعه های مولکولی که میسل نامیده می شوند، می باشد. در این صورت، به راحتی از فاز حلال، قابل تشخیص هستند، مثل ذرات چسب، نشاسته و یا قطرات روغن در آب. مخلوط های کلوئیدی یا همان محلول های غیر حقیقی را محلول های چسب مانند نیز می نامند. محلول های کلوئیدی مخلوط یکنواخت نمی باشند. اندازه ذرات در کلویید نسبت به اندازه ذرات محلول بزرگتر بوده و این ذرات به صورت معلق و پراکنده خواهند بود. به عنوان نمونه شیر را در نظر بگیرید. خود مایع شیر در حقیقت متعلق به فاز پراکنده کننده و چربی غیر محلول نیز مختص به فاز پراکنده شونده است. جالب است بدانید که اندازه ذرات فاز دوم، اغلب در محدوده یک نانومتر تا یک میکرومتر متغیر می باشند.
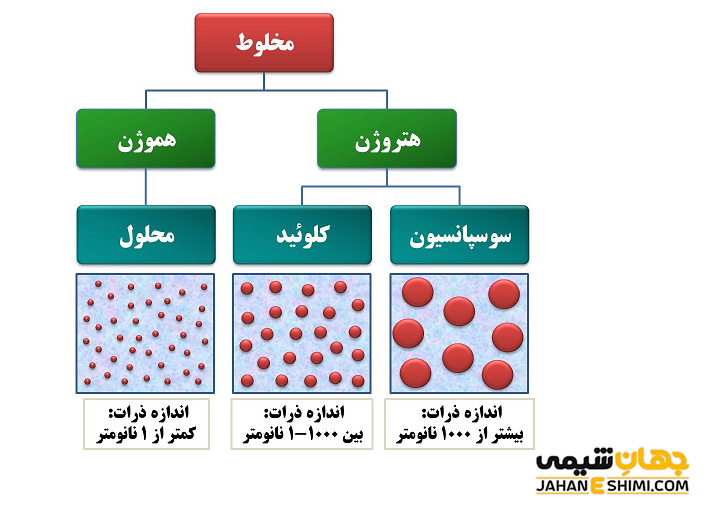
تفاوت میان محلول، کلویید و سوسپانسیون
| محلول ها | کلوئید ها | سوسپانسیون ها |
| ته نشین نمی شوند. | ته نشین نمی شوند. | با گذشت زمان در نهایت ته نشین می شوند. |
| شفاف هستند. | ظاهر کلویید ها کدر و مات دارند. | کدر می باشند. |
| بدون تغییر از صافی معمولی عبور می کنند. | بدون تغییر از صافی معمولی عبور می کنند. | به وسیله کاغذ صافی معمولی جدا می شوند. |
| اندازه ذرات در محلول، از یک نانومتر کوچک تر است. | ذرات کلویید، می توانند اندازه ای از ۱ تا ۱۰۰ نانومتر داشته باشند. | اندازه ذرات سوسپانسیون، بزرگ تر از ۱۰۰ نانومتر است. |
| بدون تغییر از غشا عبور می کنند. | به وسیله غشا جدا می شوند. | به وسیله غشا جدا می شوند. |
| مخلوطی همگن تک فازی است. | مخلوط ناهمگنی که حداقل دو فازی دارد. | مخلوطی ناهمگن جامد در مایع که حداقل دو فاز دارد. |
| پخش نور ندارند. | می توانند نور را پخش کنند. | نور را پراکنده می کنند. |
انواع مختلف کلوئید
این دسته از مواد، گوناگونی بسیاری دارند. در ادامه مقاله، طبقه بندی های مختلف کلوئید ها را بررسی می کنیم.
تقسیم بندی بر اساس فاز
فاز پراکنده شونده و همچنین فاز پراکنده کننده می توانند در هر یک از سه حالت جامد، مایع و یا گاز قرار بگیرند. در این صورت، دسته بندی کلوئیدها به چهار شکل سُل، امولسیون، کف و آیروسل خواهد بود.
- سل؛ در این سیستم کلوئیدی، فاز پراکنده کننده، مایع یا گاز است. توجه داشته باشید که اگر فاز پخش کننده آب، الکل یا بنزن باشد، به ترتیب هیدروسول یا سل آب، الکل و بنزول نامیده می شوند.
- امولسیون؛ سیستم کلوئیدی بین دو فاز مایع قرار گرفته است.
- کف یا فوم؛ به سیستم کلوئیدی گفته می شود که در آن، بیشتر ذرات گاز در فاز مایع یا جامد محبوس شده اند.
- آیروسل؛ در این سیستم کلوئیدی، محیط پراکندگی هوا (فاز گاز) می باشد.
به طور کلی می توان گفت که کلوئید ها دارای ترکیبی از همه حالت های ماده می باشند. در جدول زیر، نمونه هایی از آنها گردآوری شده است.
چند نمونه از مخلوط های کلوئیدی
| نام | مثال | فاز پراکنده شونده | فاز پراکنده کننده | حالت فیزیکی | نوع کلوئید |
| آیروسل جامد | دود، غبار، مواد اگزوز اتومبیل، ذرات معلق در هوا | جامد | گاز | گاز | جامد در گاز |
| سل | رنگ های روغنی، شیر، نشاسته در آب، چسب مایع | جامد | مایع | مایع | جامد در مایع |
| سل جامد | سرامیک، شیشه، برخی سنگ های قیمتی مانند یاقوت، لعل و فیروزه | جامد | جامد | جامد | جامد در جامد |
| ایروسل مایع | ابر، مه، شبنم، افشانه (اسپری) | مایع | گاز | گاز | مایع در گاز |
| امولسیون | شیر، مایونز، کره، کرم صورت | مایع | مایع | مایع | مایع در مایع |
| ژل | ژله، ژلاتین، ژل موی سر | مایع | جامد | جامد | مایع در جامد |
| فوم | فوم، کف، خامه زده شده، کف صابون، کرم اصلاح، کف آبجو | گاز | مایع | مایع | گاز در مایع |
| فوم جامد | سنگ پا، یونولیت، اسفنج، لاستیک، سنگ پوکه. | گاز | جامد | جامد | گاز در جامد |
| – | – | گاز | کاز | – | – |
جالب است بدانید که علاوه بر ابر و مه که حالت کلوئیدی دارند، ستارگان دنباله دار و سحابی ها نیز دارای توده های بسیار بزرگ سیستم های کلوئیدی می باشند. در واقع، درخشش ستاره های دنباله دار به دلیل پراکنده شدن نور خورشید به وسیله ذرات بسیار ریز و کوچک کلوئیدی تشکیل دهنده آنها است.
تقسیم بندی بر اساس ماهیت تعامل میان فاز پخش شونده و پخش کننده
- سل های لیوفیلی (Lyophilic sols)؛ واژه لیوفیلی به معنای دوست داشتن مایع و تمایل به آن است. بنابراین به راحتی با آنها کلوئید تشکیل می دهند. به این محلول های غیر حقیقی، کلوئید های لیوفیلی یا کلوئید های ذاتی گفته می شود. از این جهت، سل تشکیل شده، سل های لیوفیلی نامیده می شود. از جمله آنها می توان به صمغ عربی، ژلاتین، آلبومین، نشاسته و … اشاره کرد.
- سل های لیوفوبیک (Lyophobic sols)؛ کلمه لیوفوبیک به معنی متنفر بودن از مایع و عدم تمایل به آن است. بنابراین به راحتی با آنها سل تشکیل نمی دهند. به آنها، کلوئید های آبگریز یا کلوئید های خارجی گفته می شود. از این جهت، سل با استفاده از تکنیک های خاص تشکیل شده که به آنها سل های آبگریز می گویند. از جمله آنها می توان به سل فلزات (سل طلا، سل پلاتین)، سل های مواد نا محلول (مانند سولفید های فلزی و اکسید ها) اشاره کرد. لازم به ذکر است که سل های لیوفوبیک نسبت به سل های لیوفیلی، ناپایدار تر هستند. همچنین سل های آبگریز را به عنوان سل های برگشت ناپذیر می شناسند.

تقسیم بندی بر اساس نوع ذرات فاز پراکنده
- کلوئید های چند مولکولی؛ مولکول های کوچکتر یا بسیاری از اتم ها به وسیله نیرو های واندروالس در کنار یکدیگر در محلول قرار می گیرند. در این صورت، اندازه آنها در محدوده اندازه ذرات کلوئیدی است و با نام کلوئید چند مولکولی شناخته می شوند. از جمله آنها می توان به سل طلا، سل گوگرد و … اشاره کرد.
- کلوئید های ماکرومولکولی؛ در این دسته، ذرات پراکنده شده، خود مولکول هایی بزرگ با جرم مولکولی بسیار بالا (ماکرومولکول) می باشند. در واقع ابعاد آنها با ابعاد ذرات کلوئیدی قابل مقایسه است. زمانیکه این مواد در محیط پراکنده کننده مناسب، پخش شوند، محلول های کلوئیدی حاصل را کلوئیدهای ماکرومولکولی می گویند. به عنوان مثال، اغلب سل های لیوفوبیک در دسته کلوئید های ماکرومولکولی قرار می گیرند.
- کلوئید های مرتبط (میسل)؛ این دسته شامل کلوئید های است که در غلظت های پایین به عنوان الکترولیت های قوی عمل می کنند. در حالیکه در غلظت های بالاتر و به خاطر تجمع ذرات، خواص کلوئیدی از خود بروز می دهند. به عبارت دیگر، تجمع ذرات در چنین حالتی را میسل می نامند. کلوئیدهای میسل بیشتر به وسیله سورفاکتانت ها یا همان عوامل فعال سطح همچون صابون و دیگر شوینده های مصنوعی تشکیل می شوند.
خواص و ویژگی های کلوئید ها
کلویید ها دارای خواص ویژه ای مانند اثر تاندال، خواص الکتریکی، حرکت براونی، جذب و … می باشند. در ادامه با برخی ویژگی های این گروه از مخلوط ها بیشتر آشنا خواهید شد.
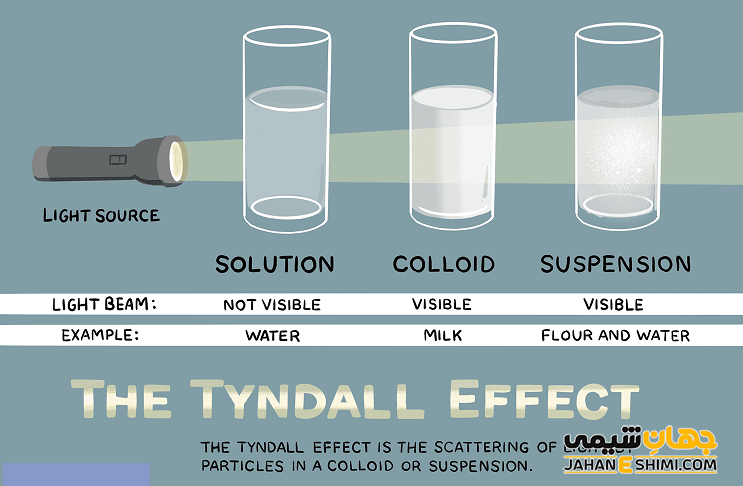
پراکندن نور یا اثر تیندال
کلوئید ها بر خلاف محلول ها که شفاف اند، ظاهری کدر و مات دارند. علاوه بر آن، ذرات تشکیل دهنده آنها به قدری بزرگ هستند که باعث پخش شدن نور عبوری از خود می شوند. این پدیده (پخش نور به وسیله ذرات کلوییدی) را اثر تیندال (Tyndall Effect) می نامند. این اثر را می توان در عبور پرتو های نور خورشید از میان هوای آلوده به غبار یا هوای مه آلود دید.

بار الکتریکی
یکی از مهمترین ویژگی های ذرات پراکنده شونده کلوییدی، باردار بودن آنها است. ذرات کلوئیدی در حقیقت بار الکتریکی خود را از طریق جذب یون های موجود در محیط پراکنده کننده بدست می آورند. بار الکتریکی می تواند مثبت و یا منفی باشد. مقدار بار ذرات کلوییدی بسته به اندازه و ابعاد آنها متفاوت است. دقت داشته باشید که تمامی ذرات تشکیل دهنده فاز پراکنده شونده، یک نوع بار الکتریکی خواهند داشت. همنام بودن بارها باعث پایداری سیستم کلوئید خواهد بود، زیرا ذرات کلوئیدی دارای بار الکتریکی یکسان، همدیگر را دفع می کنند. در نتیجه مانع از تجمع و بهم پیوستن ذرات کلوییدی، لخته شدن و یا ته نشین شدن آنها می شوند.
جالب است بدانید که با افزودن الکترولیت به یک ترکیب کلوییدی، ذرات آن ته نشین می شوند. در واقع ذرات باردار الکترولیت بین ذرات کلوئیدی قرار می گیرند و سبب کاهش دافعه میان آنها می شوند. با کم شدن این دافعه، ذرات کلوئیدی تجمع کرده و در نتیجه باعث انعقاد آنها می شود. در نهایت، ته نشین شدن ذرات را به دنبال خواهد داشت. به این پدیده، لخته شدن کلوئید می گویند.
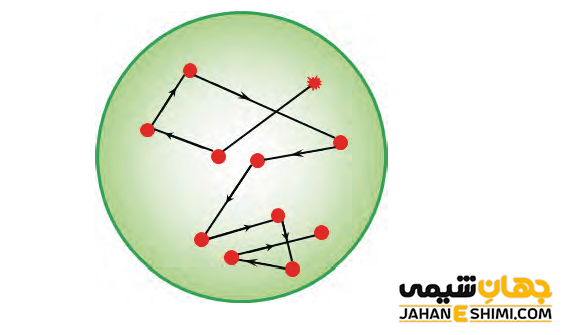
حرکت براونی
ذرات کلوئیدی که جرم پایینی دارند همچون گاز ها دایما در حال حرکت می باشند. این ذرات زمانیکه به همدیگر برخورد کنند تغییر مسیر می دهند. همچنین همواره از طرف مولکول های حلال نیز به اطراف پرت می شوند. به این حرکت و جنب و جوش دایمی و نا منظم ذرات کلوییدی، حرکت براونی گفته می شود.
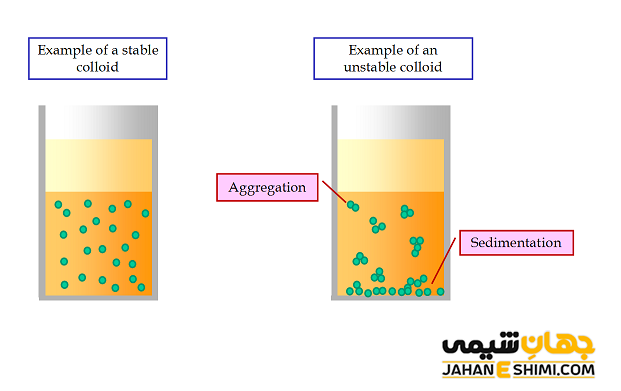
عدم پایداری لازم یا تخریب حالت کلوئیدی
در اثر اعمال برخی تغییرات مانند گرم کردن یا جوشاندن، انجماد یا یخ زدن، سانتریفوژ بر روی آنها، افزودن الکترولیت ها و همچنین تشکیل رسوب به وسیله اضافه کردن کلوئید با بار مخالف سبب ایجاد لخته یا رسوب در آنها می شود. در این صورت فاز پراکنده شونده از محیط پراکندگی جدا می گردد.
جذب
از آن جهت که ذرات کلوییدی بسیار کوچک و ریز می باشند، پس مساحت سطح زیادی نسبت به وزنشان دارند. به بیان دیگر، سطح آنها بسیار بزرگ است، بنابراین قدرت جذبشان بسیار بالا خواهد بود. اما جالب است بدانید که عمل جذب به صورت انتخابی است، یعنی بعضی از یون ها یا مایعات، گازها و جامدات را جذب و مابقی دفع می گردند.
ناهمگنی
همانطور که بیان شد، بر خلاف محلول های واقعی، محلول کلوییدی همیشه نا همگن هستند.
قابلیت صاف شدن
ذرات ریز محلول های کلوییدی به راحتی از منافذ کاغذ های صافی رد می شوند. بنابراین در آزمایشگاه ها، بشقاب های چینی لعاب نخورده مورد استفاده قرار می گیرند.
کاربرد کلوئید ها
محلول های کلوییدی بسیار ارزشمند هستند و در صنایع مختلفی از جمله صنایع غذایی (تخم مرغ، شیر، کره، سس مایونز، ژله، ژلاتین و …)، صنایع دارویی، رنگ ها، پلاستیک ها، جوهر ها، کاغذ سازی، صابون ها، مواد شوینده، مواد پاک کننده، مواد آرایشی، خمیر دندان ها، لوسیون ها، حشره کش های کشاورزی، سیمان ها، مواد روان کننده، چسب ها، سرامیک، لعاب کاری، نساجی، چرم سازی، تصفیه فاضلاب، تصفیه هوا و ساختن آلیاژهای مرغوب کاربرد دارند. برخی فلزات کلوئیدی من جمله یاقوت، لعل، فیروزه و… در ساخت ظروف و جواهرات گران قیمت مورد استفاده قرار می گیرند.

بیشتر شربت های مورد استفاده در صنعت داروسازی حالت کلوئیدی دارند. محلول های کلوئیدی به منظور افزایش حجم پلاسما در بیماران مبتلا به هیپوولمی بعد از عمل جراحی کاربرد دارند. همچنین کلوئید های نقره را به عنوان آنتی بیوتیک بکار می برند که می توانند آنزیم های موجود در باکتری، قارچ و یا ویروس را غیر فعال نمایند. کلوئید های مس و کلوئید های جیوه به ترتیب دارای عملکرد های ضد سرطان و ضد صرع می باشند. کلوئید ها همچنین می توانند بخشی از مکانیسم های نقل و انتقال دارو باشند (مانند هیدروژل، میسل، میکروامولسیون، لیپوزوم، نانوذرات و نانوکریستال).




















کارتون درسته دمتون گرم به من که کمک خوبی کردید
من دانشجوی شیمی هستم فوق العاده مطالب برام مفید بود و استفاده کردم ممنون از شما